*仅供医学专业人士阅读参考
2022 ASCO 洞悉晚期尿路上皮癌精准治疗新进展
引言
美国临床肿瘤学会(ASCO)年会作为全球规模最大、学术水平最高的临床肿瘤学会议之一,每年都吸引着全球肿瘤诊疗领域专家学者的目光,发布的最新研究进展也可能对肿瘤诊疗格局产生深远影响。今年ASCO年会公布了多项晚期尿路上皮癌相关重磅研究。其中,精准靶向治疗的相关研究进展更是引人关注。“医学界”特邀中山大学孙逸仙纪念医院黄健教授、香港大学深圳医院卢振权教授带您解读领域最新进展,探秘择“优”治疗的晚期尿路上皮癌精准治疗之路。
专家简介

卢振权 教授
香港大学深圳医院外科部顾问医生、泌尿外科助理主管
深圳市泌尿外科医师协会副会长
广东省医师协会泌尿外科学常委
世界华人泌尿外科学会(WCUS)委员
中国性医学会前列腺病常务委员
香港大学医学院荣誉副教授
擅长泌尿系统及男科肿瘤、结石等疾病的精准诊断及应用机器人等先进微创技术解决泌尿系肿瘤等专科疾病。对前列腺疾病(肿瘤、增生、炎症)、肾上腺肿瘤、膀胱肿瘤、男性精索静脉曲张等男性疾病的微创治疗积累了丰富的经验。香港大学深圳医院泌尿系肿瘤多学科诊疗团队顺应国家粤港澳大湾区(Guangdong-Hong Kong-Macao Greater Bay Area,GBA)政策,在国内率先引入FGFR靶向药物厄达替尼,为晚期进展性膀胱癌患者带来新曙光。
困境重重——晚期尿路上皮癌治疗现状和未满足临床需求
尿路上皮癌(UC)是起源于尿路上皮的一种多源性恶性肿瘤,包括肾盂癌、输尿管癌、膀胱癌以及尿道癌,是最常见的泌尿系统肿瘤,其中膀胱癌最常见,根据Globocan 2020报告:2020年我国新发膀胱癌患者数量达8.5万例,全球占比14.9%,死亡人数达3.9万例,全球占比18.5%[1]。一旦出现转移,提示尿路上皮癌进入疾病终末期,预后不佳,5年生存率约5%[2]。
对于晚期尿路上皮癌患者而言,现有治疗选择有限且疗效欠佳。在今年ASCO年会上公布的一项真实世界研究:在适合(cisplatin-eligibility,cis-e)和不适合顺铂治疗(cisplatin-ineligibility,cis-i)的晚期尿路上皮癌患者中探索一线治疗的治疗模式和临床结局[3],结果显示:在4300例晚期尿路上皮癌患者中,3311例(77.0%)接受了一线治疗,其中,1836例患者(55.5%)cis-i,1475例患者(44.5%)cis-e。其中,23%患者未接受任何一线治疗,接受一线治疗患者中仅44.4%接受了二线治疗,相比较cis-i患者(38.3%),更多cis-e患者接受二线治疗(52.0%)。接受一线治疗患者中,59.6%的cis-e患者未接受含顺铂的联合治疗,而12.5%的cis-i患者则接受含顺铂的联合治疗,这提示医生考虑除常规标准之外的临床因素评估顺铂耐受性。
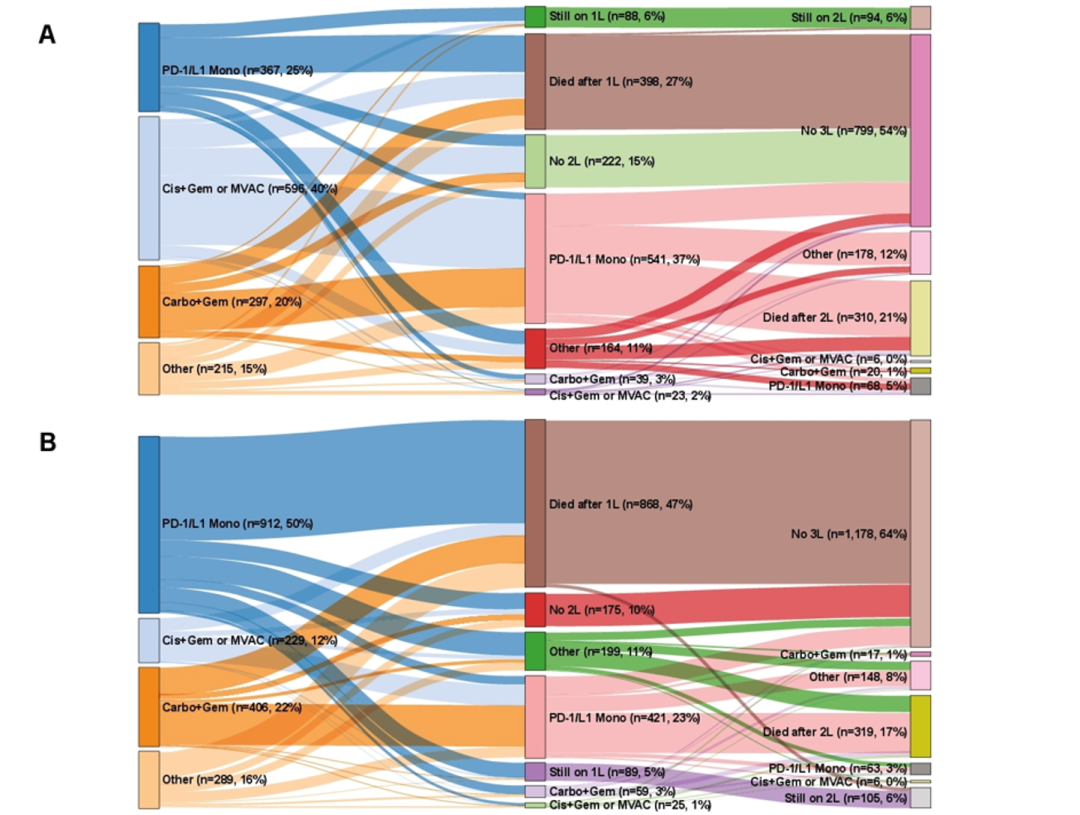
图1 治疗方案(A)顺铂耐受患者(B)顺铂不耐受患者接受的一线治疗
研究中,接受一线治疗患者的中位总生存期(mOS)为11.0个月,其中cis-i组mOS显著差于cis-e组(8.6个月vs. 14.4个月)。与其他治疗方案相比,顺铂联合吉西他滨(GC)或MVAC方案患者的mOS更长,无论顺铂耐受(20.6个月 vs. 11.7-13.0个月)还是顺铂不耐受(13.5个月 vs.6.4-9.8个月)。
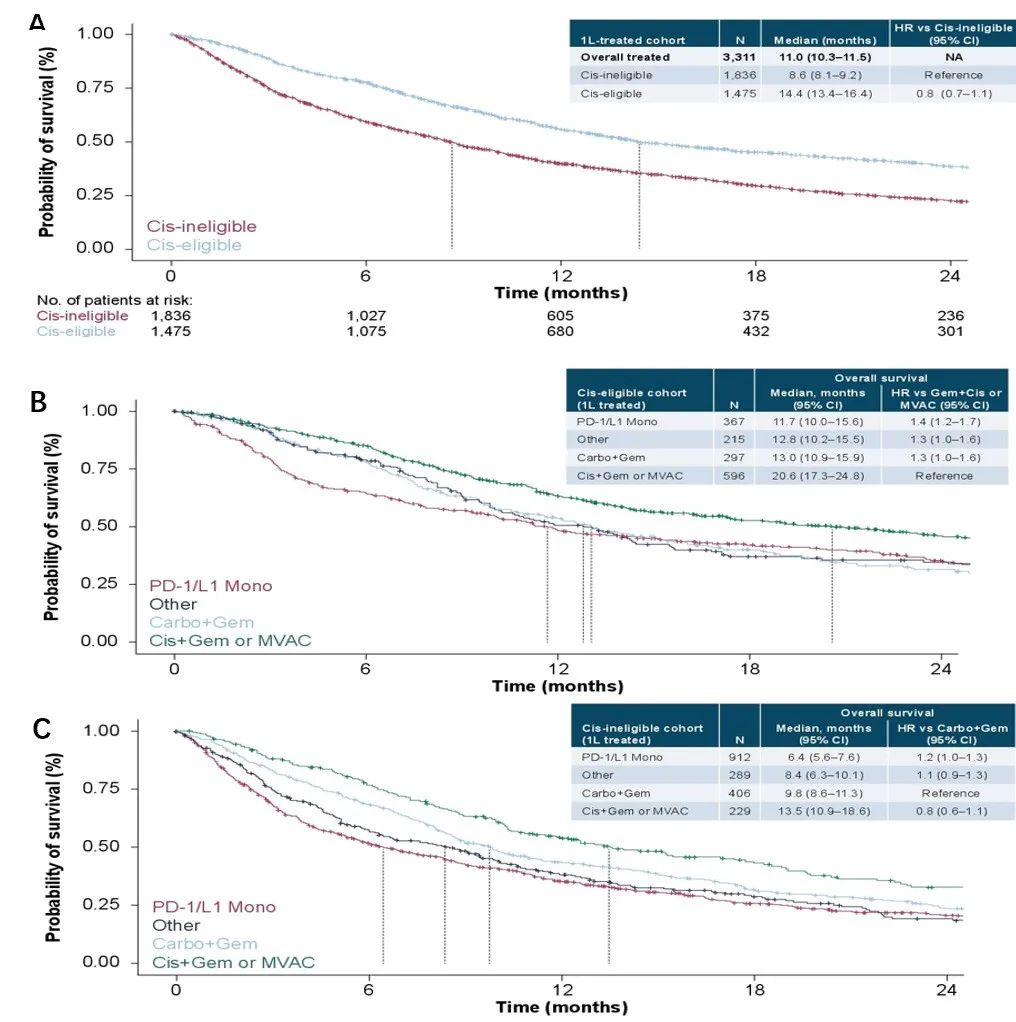
图2 (A)根据顺铂耐受性不同,接受一线治疗患者的总生存;依据不同治疗方案:(B)顺铂耐受患者一线治疗的总生存,(C)顺铂不耐受患者一线治疗的总生存
研究提示:晚期尿路上皮癌一线治疗临床疗效仍较差,部分原因可能与特定用药方案及顺铂不耐受相关;同时,仍有很多晚期尿路上皮癌患者未接受任何一线治疗和二线治疗。此外,医生在评估顺铂耐受性时存在主观性,考虑常规标准外的因素,导致部分患者治疗方案并未遵从指南推荐,原因可能是临床实践中的现实问题,如现有治疗方案的耐受性,药物的安全性,伴合并症等。综上,晚期尿路上皮癌仍存在高度未满足需求,急需可改善现有临床疗效和耐受性的新型治疗方案(尤其是顺铂不耐受人群)。
初现端倪——明确优势人群,开展精准治疗,提高临床获益
2016年FDA批准阿特利珠单抗用于晚期尿路上皮癌二线治疗,标志着晚期尿路上皮癌免疫治疗时代的到来,然而免疫时代的探索并非一帆风顺。KEYNOTE-361研究在既往不适合接受任何含铂化疗且未接受过系统性治疗的晚期尿路上皮癌患者中,相较于单独化疗,帕博利珠单抗联合化疗未显著延长患者无进展生存(PFS)和OS,帕博利珠单抗单药在总人群和PD-L1高表达(CPS≥10)人群中OS获益与单独化疗相似[4]。IMvigor130研究显示:相比于含铂化疗,阿特利株单抗单药治疗仅在PD-L1 IC2/3晚期尿路上皮癌亚组患者显示OS获益[5]。由此可见,一线免疫治疗临床获益有限,PD-L1高表达患者获益的可能更大。
相比一线,目前全球已有多款免疫检查点抑制剂获批晚期尿路上皮癌二线治疗适应症,国产的特瑞普利单抗和替雷利珠单抗(PD-L1高表达)也写入国内指南二线推荐方案。然而,III期RCT研究IMvigor211和DANUBE的失败导致阿特利珠单抗和度伐利尤单抗晚期膀胱癌二线适应症撤销[6][7],提示晚期尿路上皮癌二线免疫检查点抑制剂仍存在不确定性。
晚期尿路上皮癌中,免疫检查点抑制剂的临床疗效差异与肿瘤免疫微环境存在一定关系,仅检测PD-L1表达水平可能不足以筛选出免疫检查点抑制剂“优势”人群。在今年ASCO年会上一项通过基因组驱动因素和肿瘤微环境(tumor microenvironment,TME)来定义尿路上皮癌的分类并预测免疫检查点抑制剂疗效的研究显示:根据肿瘤免疫微环境将尿路上皮癌分为7个亚型,分别对应不同的预后、免疫检查点抑制剂应答率和可成药靶点(图3,图4)。其中,IE亚型(Immune Enriched,Non-Fibrotic)、IE-F亚型(Immune Enriched,Fibrotic)和NE-L亚型(Neuroendocrine-like)是免疫检查点抑制剂潜在获益人群,D亚型(Immune Desert)可能从HER2抑制剂和PARP抑制剂治疗中获益,而FGFR抑制剂可能更适合D-FGFR亚型(Immune Desert,FGFR-Altered),TGFβ抑制剂和PARP抑制剂可能对F亚型(Fibrotic)有效,而F-B亚型(Fibrotic-Basal)则无相关靶点结果[8]。
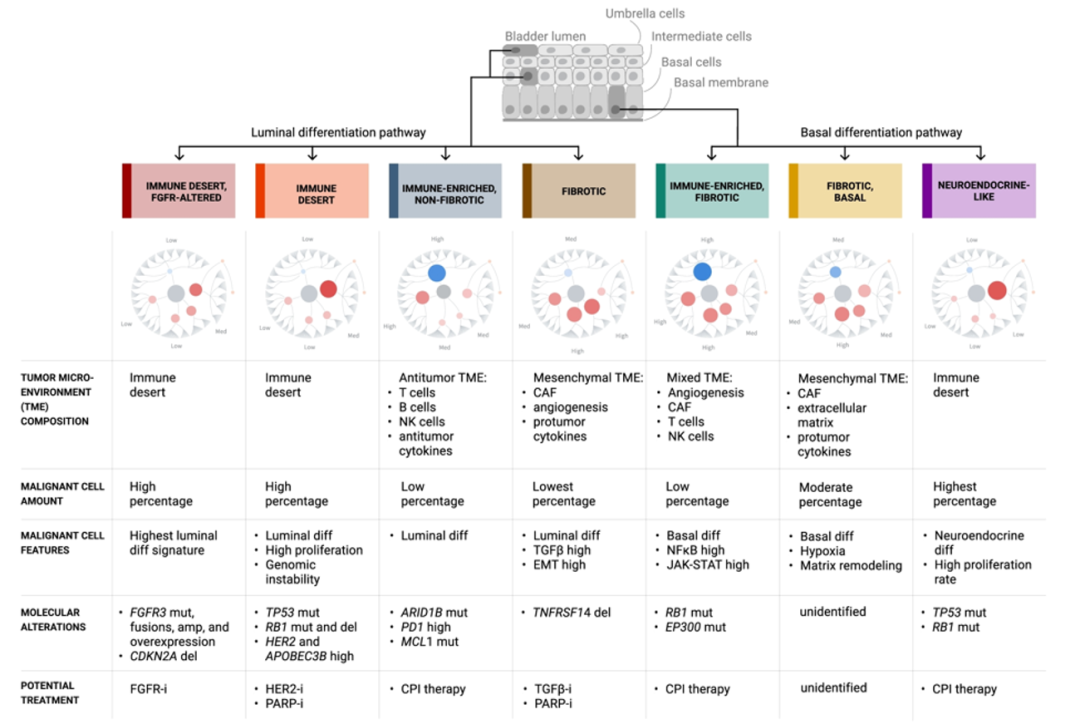
图3 不同尿路上皮癌亚型的TME,恶性细胞特征和基因组驱动因素
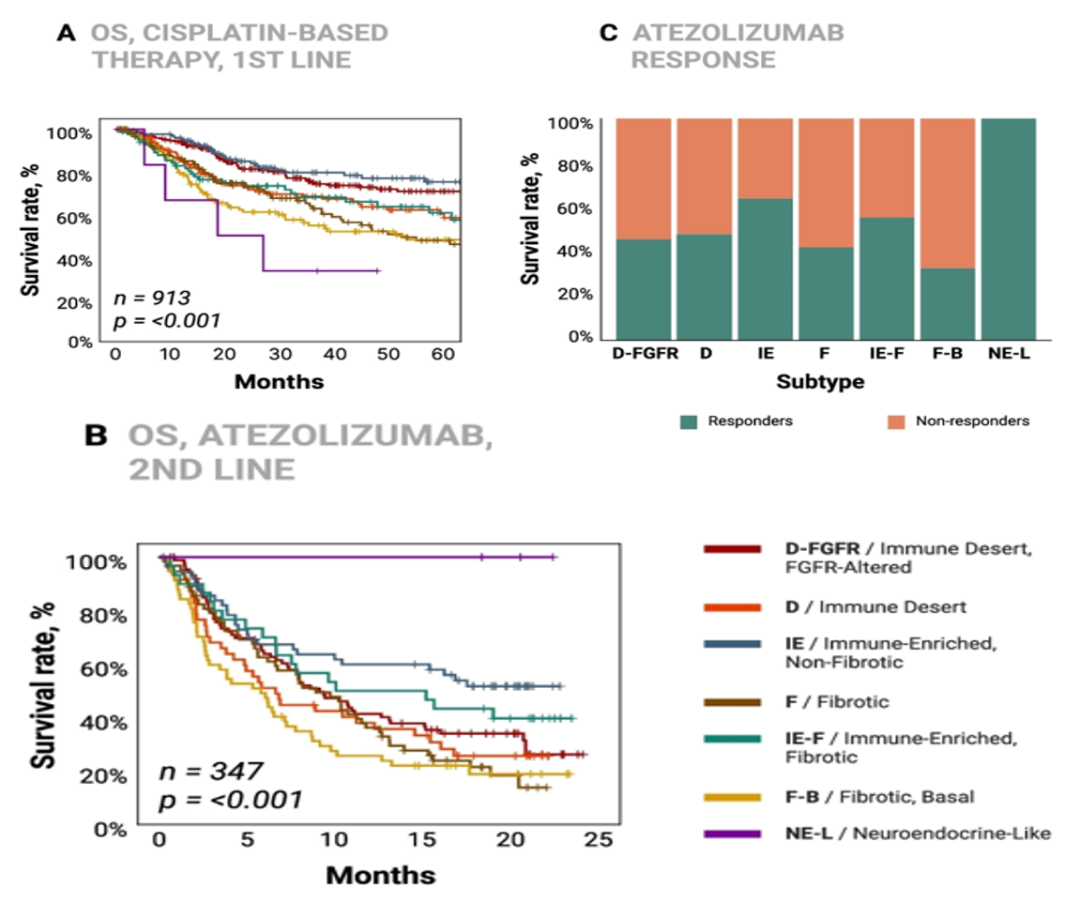
图4 不同尿路上皮癌亚型的生存预后和免疫检查点抑制剂应答预测
无独有偶,在今年ASCO-GU年会报道的一项探索PD-L1表达与传统尿路上皮膀胱癌基因组改变之间关系的研究提示:PD-L1表达阴性的膀胱尿路上皮癌具有更高频率的靶向FGFR3 基因组改变和潜在靶向基因组改变(包括ERBB2、ERBB3和PIK3CA)(表1)[9]。
表1 研究中PD-1表达水平与膀胱癌基因组改变的情况

此外,ASCO年会报道了特瑞普利单药二线治疗转移性尿路上皮癌的2年生存及生物标记物的研究结果(POLARIS-03)[10]:15家中心、151例转移性尿路上皮癌患者,ITT人群ORR为26.5%,高TMB患者的ORR、PFS和OS均优于低TMB患者(cut-off值10 muts/Mb)。研究入组存在FGFR2/3基因突变或融合的患者20例,ORR为30%(6/20),但并未阐明20例患者PD-L1和TMB的表达情况。相反,BLC2001研究探索性分析显示:选定厄达替尼方案组(8mg/日,药效学指导下剂量增加至9mg/日)中,研究入组前接受过免疫治疗的22例患者中仅1例(5%)对既往免疫治疗有应答。
随着研究的深入,尿路上皮癌的分子分型也许可以协助临床医生精准识别“优势”患者群,从而选择最适合的治疗方案。
拨云见日——靶向治疗是晚期尿路上皮癌的探索方向
2019年美国FDA加速批准厄达替尼用于存在 FGFR3 或 FGFR2 易感型基因改变的局部进展或转移的晚期尿路上皮癌,开启了尿路上皮癌靶向治疗时代。目前,在多种恶性肿瘤中均发现FGFR的异常表达,包括基因扩增、染色体易位、重排、单位点突变以及基因融合等[11]。在不同瘤种中,现有国内和国际数据均显示,FGFR基因改变在尿路上皮癌中最常见[11],提示FGFR靶向治疗可能给尿路上皮癌患者带来潜在获益。BLC2001 Ⅱ期研究[12]中,使用选定厄达替尼方案(8mg/日,药效学指导下剂量增加至9mg/日)治疗存在FGFR基因改变的晚期尿路上皮癌患者疗效显著,中位疗效随访24.0个月,研究者评估的ORR为40%,mPFS为5.5个月,mOS为11.3个月,12个月生存率为49%,24个月生存率为31%(图5)。安全性特征与主要分析相似,随着随访时间的延长,未报告新的安全性问题。
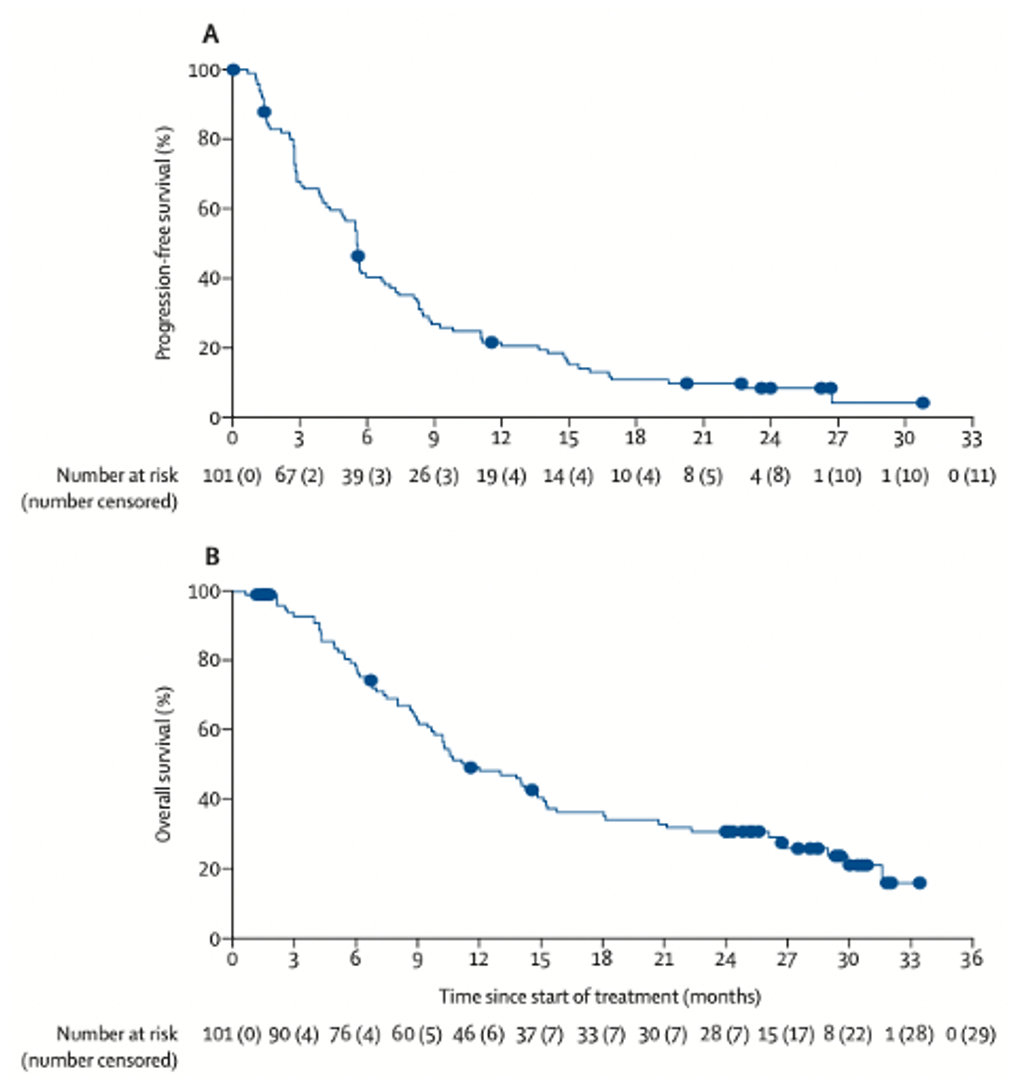
图5 BLC2001研究的无进展生存和总生存
如前所述,D和D-FGFR分子亚型的尿路上皮癌患者适合接受针对HER-2和FGFR的靶向治疗,相关研究提示HER2改变和FGFR3突变/融合可能是膀胱癌中相互排斥的致癌驱动因素(图6 )[13]。本次ASCO年会中, 国产RC48-ADC治疗HER2阳性的转移性尿路上皮癌患者的RC48-C005和RC48-C009研究合并分析显示:HER2 IHC2+和FISH+或IHC3+的患者ORR为62.2%(28/45) , HER2 IHC2+与FISH未知患者ORR为55.6%(5/9),HER2 IHC2+和FISH- 患者ORR为39.6%(21/53)[14]。RC48-ADC治疗HER2阴性(HER2 IHC1+或0)局部晚期或转移性尿路上皮癌患者的II期、单中心、单臂研究入组19例患者ORR为26.3%[15]。上述2项研究初步显示出RC48-ADC临床缓解率与HER2不同表达水平相关,HER-2高表达患者临床获益更显著。

图6 膀胱癌中HER2改变和FGFR3突变/融合是相互排斥的致癌驱动因素
综上,在尿路上皮癌中,免疫检查点抑制剂引发精准治疗的深入思考,厄达替尼开启了精准治疗的时代,RC48-ADC等药物和生物标记物的发展会给患者带来更多的治疗选择和生存的希望。
专家简介

黄健 教授
中山大学孙逸仙纪念医院泌尿外科主任,教授、主任医师、博士生导师
中华医学会泌尿外科学分会主任委员
中国医师协会医学机器人医师分会副会长
中华医学会泌尿外科学分会 肿瘤学组组长
中国医疗器械行业协会泌尿外科与男科器械专业委员会副会长
《中国泌尿外科和男科疾病诊断治疗指南》主编
《中华泌尿外科杂志》总编辑
《中华腔镜泌尿外科杂志》、《微创泌尿外科杂志》副主编
《International Journal of Urology》
《Asian Journal of Urology》
《Journal of Endourology》等杂志编委
专家点评
长期以来尿路上皮癌的治疗发展相对缓慢,近年来免疫检查点抑制剂、靶向治疗药物的获批,对尿路上皮癌的治疗格局产生了深远的影响。目前,晚期尿路上皮癌的一线和二线治疗选择仍相对有限,虽然免疫检查点抑制剂在部分患者中临床获益显著,但并非所有患者均能获益于免疫检查点抑制剂治疗。随着靶向药物厄达替尼的获批,晚期尿路上皮癌迈入精准治疗时代,同时针对尿路上皮癌的分子分型、生物标记物和靶向药物等相关研究也日渐深入。今年ASCO年会的多项研究结果提示我们,精准治疗的时代背景下,免疫检查点抑制剂和靶向治疗的前提都是“优势”治疗人群的精准识别,在此基础上才能科学且高效的指导临床用药抉择。相信随着更多靶向药物的研发和上市,晚期尿路上皮癌治疗格局或将重新定义。
参考文献:
[1] China Source: Globocan 2020. Global Cancer Observatory: Cancer Today. Lyon, France: International Agency for Research on Cancer.
https://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf
[2] Knowles MA, Hurst CD. Molecular biology of bladder cancer: new insights into pathogenesis and clinical diversity. Nat Rev Cancer. 2015;15(1): 25-41.
[3] Guru P. Sonpavde, et al. Real-world treatment patterns and clinical outcomes with first-line therapy in cisplatin-eligible and ineligible patients with advanced urothelial carcinoma. 2022 ASCO Poster Session 4565
[4] Thomas Powles, Tibor Csoszi et al Pembrolizumab alone or combined with chemotherapy versus chemotherapy as first-line therapy for advanced urothelial carcinoma (KEYNOTE-361): a randomised, open-label, phase 3 trial Lancet Oncol. 2021 Jul;22(7):931-945.
[5] Galsky MD,et al. Atezolizumab with or without chemotherapy in metastatic urothelial cancer (IMvigor130): a multicentre, randomised, placebo-controlled phase 3 trial Lancet.2020;395:1547-57.
[6] Powles T, et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211): a multicentre, open-label, phase 3 randomised controlled trial Lancet. 2018;391:748-757.
[7] homas Powles, et al. Durvalumab alone and durvalumab plus tremelimumab versus chemotherapy in previously untreated patients with unresectable, locally advanced or metastatic urothelial carcinoma (DANUBE): a randomised, open-label, multicentre, phase 3 trial Lancet Oncol. 2020 Dec;21(12):1574-1588.
[8] Konstantin Chernyshov, et al. A classification system for urothelial carcinoma (UC) defined by genomic drivers and the tumor microenvironment (TME) is predictive of immunotherapy response. 2022 ASCO Poster Session 4591
[9] Grivas, Andrea Necchi, et al. Impact of PD-L1 expression on conventional urothelial bladder carcinoma (UBC) genomic alteration (GA) profile. 2022 ASCO-GU Poster sessionPetros 563
[10] Haige Chen, et al. Toripalimab (anti-PD-1) monotherapy as a second-line treatment for patients with metastatic urothelial carcinoma (POLARIS-03): Two-year survival update and biomarker analysis. 2022 ASCO Genitourinary Cancer—Kidney and Bladder. Poster Discussion Session.4566
[11] Touat M, Ileana E, et al. Targeting FGFR Signaling in Cancer. Clin Cancer Res. 2015;21 (12): 2684-94.
[12] Siefker-Radtke AO, et al. BLC2001 Study Group. Efficacy and safety of erdafitinib in patients with locally advanced or metastatic urothelial carcinoma: long-term follow-up of a phase 2 study. Lancet Oncol. 2022 Feb;23(2):248-258. doi: 10.1016/S1470-2045(21)00660-4. Epub 2022 Jan 11.
[13] Michael Lattanzi, et al. Incidence and clinical outcomes of HER2-altered bladder cancer (BC) patients (pts) .2022 ASCO-GU Poster session.
[14] Xinan Sheng, et al. Key Laboratory of Carcinogenesis and Translational Research RC48-ADC for metastatic urothelial carcinoma with HER2-positive: Combined analysis of RC48-C005 and RC48-C009 trials..2022 ASCO Genitourinary Cancer—Kidney and Bladder. Poster Discussion Session.4520
[15] Huayan Xu, et al. Key Laboratory of Carcinogenesis and Translational Research. A phase II study of RC48-ADC in HER2-negative patients with locally advanced or metastatic urothelial carcinoma. 2022 ASCO Genitourinary Cancer—Kidney and Bladder. Poster Discussion Session.4519
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |