
研究背景
前列腺癌一旦进展为mCRPC,预后一般较差,生存获益低。发生远处转移的患者,5年相对生存率从未转移患者的80%降至30%,无进展生存时间是未转移患者的一半。因此,mCRPC一线治疗是疾病治疗过程中的关键阶段。联合治疗因能够带给mCRPC患者更好的生存获益而逐渐成为mCRPC一线治疗的热点。随着高质量临床研究结果的获得,势必引起晚期PCa治疗方案的迭代和更新。
Ⅲ期临床研究PROpel证实奥拉帕利联合阿比特龙是有史以来首个在mCRPC一线全人群影像学无进展生存突破2年的治疗方案,其意义深远。此次《CSCO前列腺癌指南(2022版)》 “去势抵抗性前列腺癌的诊疗”章节,新增奥拉帕利联合阿比特龙作为mCRPC人群的治疗选择。本文特别邀请北京大学肿瘤医院盛锡楠教授对奥拉帕利联合阿比特龙的治疗机制及PROpel研究展开解读。
奥拉帕利联合阿比特龙
联合治疗的机制
以奥拉帕利为代表的PARP抑制剂(PARPi)既往已被证实可以通过“合成致死”作用治疗携带同源重组修复(HRR)基因突变的mCRPC患者。PARP1和PARP2是DNA损伤反应机制的组成部分,对于维持DNA完整性至关重要。PARPi可在受损DNA处捕获PARP1和PARP2酶,形成的复合物致DNA复制停滞、DNA断裂,产生比单纯PARP失活引起的未修复单链断裂具有更大的细胞毒性,即“合成致死”效应。
雄激素与PCa的发生发展关系密切,雄激素受体轴靶向性(ARAT)的药物(如阿比特龙)为晚期PCa患者带来了有目共睹的生存获益。PARP不仅可与转录因子ERG发生相互作用,还调节AR与染色质的结合,抑制PARP可PCa细胞对DNA损伤和雄激素消耗敏感。此外,PCa中DDR信号通路(含有HRR基因)和AR信号通路存在交叉,AR信号的抑制或AR的缺失可导致HRR表达降低。
由此推测,药物诱导AR功能的下降使得HRR基因(如BRCA1、RAD51AP1、RMI2等)表达减少/缺乏,增强PARPi的作用。因此,靶向AR的药物和靶向PARP的药物如奥拉帕利可在PCa中产生协同性杀伤力。
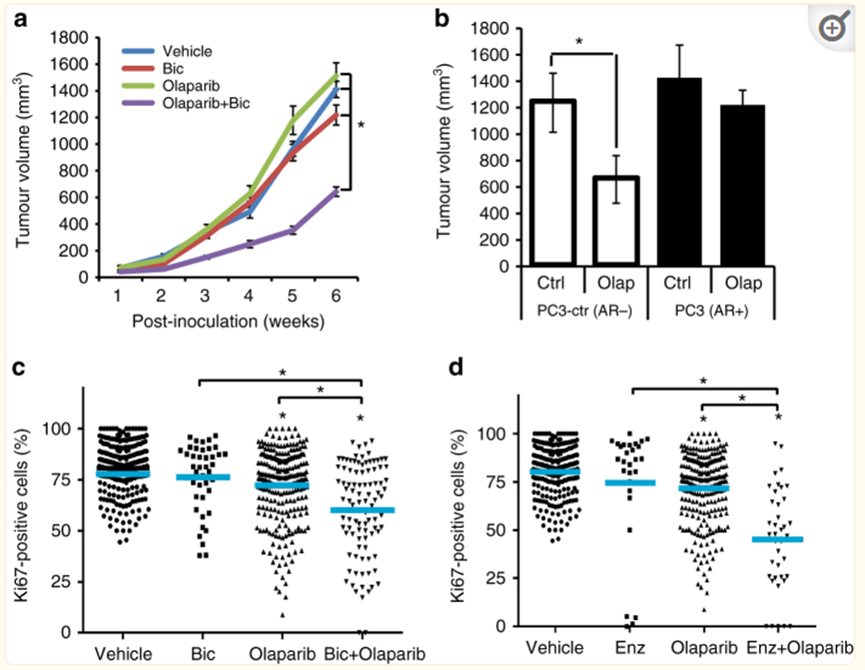
Dual inhibition of ARand PARP1/2 function represses PCa growth.
AR信号和PARP1/2的双重抑制作用抑制Pca生长
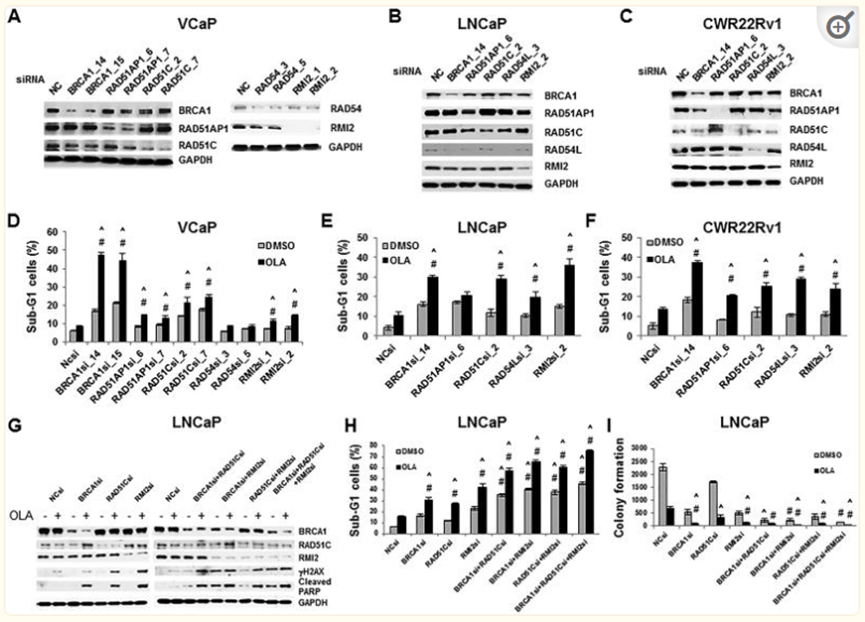
HRR gene silencingsynergizes with OLA to increase cytotoxicity to PCa cells
HRR基因沉默与OLA协同增加对PCa细胞的细胞毒性
简而言之,奥拉帕利可减弱AR通路转录活性,而ARAT(阿比特龙)可诱导HRR缺陷、下调DDR基因转录,对PARPi具有一定的增敏作用。因此,奥拉帕利与阿比特龙联合可发挥1+1&2的协同抗肿瘤作用,并且与PCa患者的HRR是否发生突变无关。
Ⅱ期临床研究Study 08表明,奥拉帕利联合阿比特龙治疗给mCRPC患者(无论HRR突变状态)带来显著的临床获益,且整体安全性良好。随后联合疗法进入Ⅲ期PROpel研究进行确证,并于2022 ASCO-GU 上口头报道了研究结果。全文刊登于NEJM子刊《NEJM Evidence》。
PROpel研究解读
研究目的
确证奥拉帕利联合阿比特龙在mCRPC一线全人群中的疗效和安全性。
研究设计
PROpel是一项全球多中心,随机,双盲Ⅲ期临床研究。纳入mCRPC一线患者796例,入组患者不考虑HRR突变状态,以1:1随机进入奥拉帕利(300mg bid)联合阿比特龙(1000mg qd)治疗组或安慰剂联合阿比特龙(1000mg qd)治疗组。两组患者基线平衡,尤其是两组患者HRR突变比例基线平衡。研究的主要终点为由研究者评估的影像学无进展生存(rPFS),同时探索了包括总生存期(OS)在内的多个次要终点。
研究结果
主要终点rPFS:
奥拉帕利联合阿比特龙与阿比特龙单药治疗相比,研究者评估的中位rPFS延长8.2个月(24.8vs 16.6个月,HR 0.66, 95%CI 0.54-0.81, P<0.0001),降低了34%的影像学进展或死亡风险,且无论患者HRR状态如何;BICR评估显示联合治疗比较单药能够延长中位rPFS达11.2个月(27.6 vs 16.4个月,HR0.61, 95%CI 0.49-0.74, P<0.0001),降低了39%的影像学进展或死亡风险;亚组分析显示,所有亚组的rPFS均有所改善,包括富集肿瘤组织和循环肿瘤DNA检测到的HRR突变患者(HR 0.50,95%CI0.34–0.73)和未检测到HRR突变的患者(HR 0.76,95%CI0.60–0.97)。
关键次要终点OS:
尽管数据尚不成熟(已有228例事件发生,数据成熟度28.6%),但已观察到奥拉帕利联合阿比特龙治疗组出现OS获益的趋势(HR 0.86,95%CI 0.66-1.12,P=0.29)。
其他次要终点:
a.TFST和PFS2奥拉帕利联合阿比特龙均显示获益,TFST (HR 0.74,95%CI 0.61-0.90,P=0.004),PFS2 (HR 0.69,95%CI 0.51-0.94,P=0.0184)。
b.研究的安全性分析 联合治疗体现了可管理可预测的安全性特征,大多数患者能够治疗至疾病进展。不良事件分析显示,联合治疗与已知的两种单药治疗的不良事件特征相一致,最常报告的3级及以上不良事件均为贫血(15.1% vs 3.3%),均未报道MDS或AML。
c.前列腺癌治疗后功能评分 联合治疗组与阿比特龙单药治疗组相较,两组患者生活质量无差异。
展望
mCRPC是PCa的终末阶段,尽管以阿比特龙为代表的新型内分泌药物已广泛被临床运用,但目前临床研究显示mCRPC患者中位OS仍不足3年,在真实世界中中位OS甚至不足2年,存在极大的未满足医学需求。PROpel研究结果为奥拉帕利联合阿比特龙在mCRPC一线的使用提供了循证医学证据,联合疗法可为mCRPC患者带来显著的临床获益。随着OS数据的成熟,有望进一步揭示奥拉帕利联合阿比特龙治疗在临床中的长期生存获益。
专家简介

盛锡楠 教授
主任医师、副教授、博士生导师
北京大学肿瘤医院泌尿肿瘤内科副主任
中国临床肿瘤学会(CSCO)理事
CSCO青年专家委员会常委
CSCO肾癌专家委员会秘书
CSCO尿路上皮癌专家委员会常委
中国抗癌协会青年理事会常务理事
中国抗癌协会泌尿肿瘤专委会肾癌学组委员
中华医学会泌尿外科分化青委会肿瘤学组副组长
北京抗癌协会泌尿生殖肿瘤专委会青委会主任委员
北京医学会罕见病分会泌尿学组副组长
参考文献:(滑动查看)
1. Schiewer MJ, et al Cancer Discov 2012;2:1134–1149;
2. Goodwin JF, et al.Cancer Discov 2013;3:1254-71;
3. Asim M, et al.Nat Commun 2017;8:37
4. Fred Saad et al.,ASCO-GU 2022, CA, abstract 11 ;
5. Hussain M, et al.New Engl J Med. 2020;383:2345-2357.
6. Loriot Y, et al.Ann Oncol.2013;24(7):1807-1812.
7. Badrising S, et al.Cancer.2014;120(7) 968-75
8. Swami U, et al.Cancers, 2021.13(19) 4951.
9.Adashek JJ,Jain RK, Zhang J. Clinical Development of PARP Inhibitors in Treating Metastatic Castration-Resistant Prostate Cancer. Cells. 2019 Aug 9;8(8):860. doi: 10.3390/cells8080860.
10. Nizialek E,Antonarakis ES. PARP Inhibitors in Metastatic Prostate Cancer: Evidence to Date. Cancer Manag Res. 2020 Sep 7;12:8105-8114. doi: 10.2147/CMAR.S227033.
11. Asim M, Tarish F, Zecchini HI, et al.Synthetic lethality between androgen receptor signalling and the PARP pathway in prostate cancer. Nat Commun. 2017;8:374. doi:10.1038/s41467-017-00393-y
12. Li L, Karanika S, Yang G, et al.Androgen receptor inhibitor-induced “BRCAness” and PARP inhibition are synthetically lethal for castration-resistant prostate cancer. Sci Signal. 2017;10.
排版:刘则伯
编辑:尹晗
| 留言与评论(共有 0 条评论) “” |