*仅供医学专业人士阅读参考
一览NRG1最新研究进展。
2022年6月3日至7日,全球肿瘤学者期待已久的年度肿瘤盛会——美国临床肿瘤学会(ASCO)年会如约而至,大会涵盖了各瘤种大型临床研究、创新研究等重磅研究结果。日前,大会已圆满落幕,但仍有多项研究结果值得进一步学习和探讨。
神经调节蛋白1(NRG1)是NRG基因家族成员之一,NRG1与多种肿瘤的发生、发展密切相关,且其发生作用的过程中导致多种与肿瘤相关的信号通路分子改变[1]。NRG1融合非常罕见,存在于各个肿瘤类型中,非小细胞肺癌(NSCLC)病例中的发生率约为0.3%[2]。NRG1基因融合是一种新兴的致癌驱动因素,可作为药物治疗的靶标。
本文总结了今年ASCO大会上,关于NRG1融合肺癌靶向治疗相关的部分研究进展[3-6],供读者参考。
CRESTONE研究:Serbantumab对NRG1融合实体瘤的初步疗效和安全性良好
NRG1融合是罕见的致癌驱动因素,在约0.2%的实体肿瘤中被发现。NRG1融合会引起ERBB3/HER3过度活化,从而促进肿瘤生长和癌细胞存活。NRG1融合的肿瘤患者采用标准治疗的疗效较差,目前也还没有针对NRG1融合阳性肿瘤的靶向治疗药物获批上市。
Serbantumab是一种完全人源抗HER3 IgG2单克隆抗体,在NRG1融合驱动的临床前研究中被证实可抑制肿瘤生长。2022ASCO大会公布了一项针对NRG1融合实体瘤的临床研究初步结果。
CRESTONE是一项在局部晚期或转移性实体肿瘤,并伴有NRG1融合的成人患者中开展的Ⅱ期、全球多中心、开放标签的临床研究。剂量范围阶段将Ⅱ期临床试验剂量确定为3g,每周静脉注射一次,直到达到治疗停止标准。在扩展阶段,队列1将纳入至少接受过一次治疗且未接受过ERBB靶向治疗的至少55例患者。扩展性队列2或3将纳入以前接受ERBB靶向治疗的患者和/或含有额外分子改变的肿瘤。本次报告了接受Serbantumab治疗(3g qw)和研究者评估应答的队列1患者的初始数据。
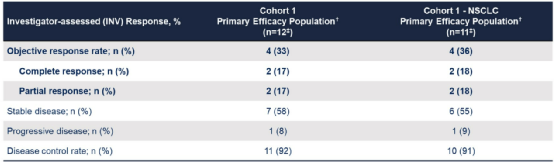
截至2022年1月13日,队列1中有12例患者接受了Serbantumab治疗(3g qw)。92%的患者确诊为NSCLC,经二代测序(NGS)发现包括5种不同的NRG1融合突变(ATP1B1、CD74、ITGB1、SDC4、SLC3A2)。在队列1患者中,客观缓解率(ORR)为33%,疾病控制率(DCR)为92%。在队列1 的NSCLC患者组中,ORR为36%,DCR为91%。
患者对Seribantumab治疗(3g qw)的耐受性良好,主要的不良反应为1级或2级,无需停药或减少药物剂量。
表1. 队列1和NSCLC患者的疾病缓解情况
初步数据表明,Serbantumab在携带NRG1融合的晚期实体肿瘤中有持久的治疗反应,并具有良好的安全性。
Zenocutuzumab在晚期NRG1融合肿瘤中,展现持久反应
NRG1与HER3结合,导致HER2/HER3异质化和致癌转化。Zenocutuzumab 是一款新型的双特异性抗体药物,可以强力结合HER2和HER3受体,从而阻断HER3和其配体NRG1的相互作用。
一项研究纳入既往接受或未接受标准治疗的NRG1融合实体瘤患者,入组后注射Zenocutuzumab(750 mg IV Q2W),直到疾病进展或出现不可接受的毒性,每8周行肿瘤影像学检查。主要终点为研究者评估的ORR,次要终点包括缓解持续时间(DOR)和安全性。
截至2022年1月12日,纳入了99例NRG1融合阳性肿瘤患者。对73例接受≥1剂量Zenocutuzumab的患者的疗效进行了评估,这些患者于2021年7月12日入组,有机会进行≥6个月的随访,并满足主要疗效人群的标准。中位年龄为59岁,58%为女性,肿瘤类型包括:NSCLC(41例)、胰腺癌(18例)、乳腺癌(5例)、胆管癌(3例)、结直肠癌(2例)和其他4种肿瘤(各1例),中位既往全身治疗线数为2。最常见的融合伙伴是CD74 (27%), SLC3A2(18%)和ATP1B1(15%)。
结果显示,在71例可评估疗效的患者中,确诊ORR为34%,其中NSCLC的ORR为35%。22例患者(13例NSCLC,6例胰腺癌,3例其他实体瘤)正在接受治疗。中位DOR为9.1个月,6个月的DOR率为76%,12个月的DOR率为27%。
在安全性方面,使用Zenocutuzumab单药治疗的208例患者中,报告的≥3级不良事件比例< 5%。
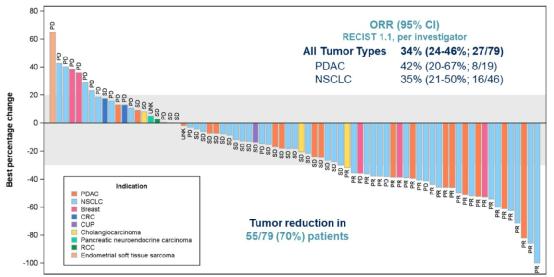
图1. 自基线起靶病灶的最佳变化
该研究证实Zenocutuzumab在晚期NRG1融合实体瘤患者中表现出了强大和持久的疗效,以及具有良好的耐受性。
探索中国NRG1融合实体瘤患者的特征
在中国患者中,基于NGS的多种实体瘤中NRG1融合的发生率的研究有限。一项研究采集FFPE样本和匹配的外周血用于NGS检测,发现共有47例患者存在NRG1融合,其中4例在RNA水平检测到NRG1融合。
NSCLC是最常见的癌症类型,NRG1融合的发生率为0.19%(25/13089)。骨肉瘤、乳腺癌、胰腺癌和结直肠癌的NRG1融合发生率分别为0.30%(3/973)、0.16%(3/1850)、0.14%(3/2098)和0.07%(3/4344)。CD74(10.1%)、SLC34A2(10.1%)和WRN(4.3%)是NRG1最常见的融合伙伴,其他已知的伙伴包括CDH1、HMBOX1、ADAM5和UNC5D。
47例NRG1融合患者中,女性(49%)和男性(51%)分布均匀,晚期(III期)占44.7%,中位年龄为57岁,中位TMB为3.3 muts/Mb。TP53(48.9%)、CDKN2A(14.9%)和ERBB2/FGFR1/MUC16/SMAD4(12.8%)是最常见的同时发生的突变基因。ERBB2突变中50%为扩增,2例为乳腺癌。只有1例患者显示ALK融合,1例显示FGFR1融合。在所有患者中,KRAS p.G12X突变占8.5%,EGFR突变占10.6%,其中包括2例L858R突变和2例19del突变。
该研究发现NRG1融合在中国NSCLC患者的发生率为0.19%,其发生率与常见肿瘤相同。NGS测序和OrigiFus算法在检测NRG1融合和提供伴侣的结构信息方面具有优势,可能可以为更精准的治疗方案提供指导。
一项在研的研究:评估阿法替尼对NRG1融合的晚期/转移性实体肿瘤患者的疗效
阿法替尼是一种不可逆的泛ErbB酪氨酸激酶抑制剂,是NRG1融合阳性肿瘤的潜在治疗方法。一项研究旨在探索阿法替尼在NRG1融合阳性实体肿瘤患者中的安全性和有效性,该前瞻性、真实世界研究将纳入40例≥18岁可评估疗效的NRG1融合阳性患者,给予阿法替尼治疗,直到疾病进展或患者不再耐受。
纳入标准包括:组织学或细胞学确诊的NRG1融合晚期、不可切除/转移、非血液系统恶性肿瘤,排除标准包括:既往接受过ErbB靶向治疗、既往用过NRG1融合之外的驱动基因突变的FDA批准靶向治疗。该研究的主要终点是独立中心评审确定的ORR,次要终点包括DOR、DCR、安全性等。

图2.研究设计
参考文献:
[1] 刘静,曹书华,赵喜,杨云琳,宁方玲.NRG1在非小细胞肺癌中的表达及机制的研究[J].吉林医学,2020,41(4):777-779.
[2] Jonna S, Feldman RA, Swenson J, et al. Detection of NRG1 gene fusions in solid tumors. Clin Cancer Res. 2019;25:4966-4972.
[3]Daniel R. Carrizosa, Mark E. Burkard, Yasir Y Elamin, et al.CRESTONE: Initial efficacy and safety of seribantumab in solid tumors harboring NRG1 fusions.2022 ASCO Abstract #3006.
[4]Alison M. Schram, Koichi Goto, Dong-Wan Kim, et al.Efficacy and safety of zenocutuzumab, a HER2 x HER3 bispecific antibody, across advanced NRG1 fusion (NRG1+) cancers. 2022 ASCO Abstract #105.
[5]Shaohua Yuan, Hui Chen, Liwei Wang,et al. The landscape of NRG1 fusions based on NGS in Chinese solid tumor patients. 2022 ASCO Abstract #e15073.
[6]Stephen V. Liu, Lori Ann E. Minasi, Matthias Herpers,et al. Efficacy of afatinib in patients with advanced/metastatic solid tumors harboring NRG1 gene fusions: A novel, prospective real-world outcomes study based on single-patient protocol data. 2022 ASCO Abstract #TPS3180.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |