*仅供医学专业人士阅读参考
打卡学习肿瘤“奇迹”病例!
目前,转移性前列腺癌的诊治逐渐成为泌尿生殖领域的热点问题。在亚洲范围内,前列腺癌的发病率低于欧美国家,转移是造成前列腺癌预后不良的主要因素。随着影像学诊断技术的进步、肿瘤治疗水平的提高带来的患者生存期延长以及对恶性肿瘤监测和随访的重视,近年来“寡转移性前列腺癌”的检出率明显升高。
本期“病例小课堂”由复旦大学附属肿瘤医院戴波教授分享一例寡转移性前列腺癌患者长生存病例。年轻的寡转移性前列腺癌患者在治疗选择相对有限的条件下,如何获得超过5年的总生存期(OS)?让我们一探究竟!
病例基本资料
64岁男性患者,肩背部疼痛2个月。2017年2月外院MRI检查示:胸2椎体病理性骨折,肿瘤转移待排除,颈3-7椎间盘突出伴椎管狭窄。2017年2月复旦大学附属肿瘤医院肿瘤标记物检查示:TPSA 77.840 ng/ml,余肿瘤标记物检查均在正常范围内。
患者9年前有甲状腺良性肿瘤病史,高血压病史15年余,降压药物控制可。查体示:ECOG评分:0-1分,腹部平软,膀胱区无压痛,前列腺Ⅲ度大,左侧叶质地较硬,右侧叶质地较韧实。
2017年2月PET-CT示:前列腺左叶低密度占位,未见FDG代谢增高,建议穿刺;T2椎体压缩性骨折;左侧髂骨致密结节,FDG代谢增高。
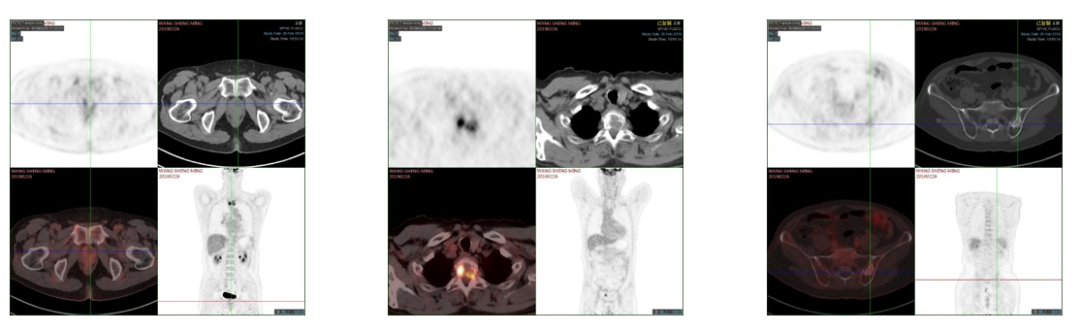
2017年2月PET-CT资料
2017年2月复旦大学附属肿瘤医院MR检查示:前列腺尖部偏左侧异常信号灶;其周围不均匀强化灶,结合病史,符合恶性肿瘤改变。右侧前列腺尖部及相邻盆腔肌肉不均匀强化灶,左侧髂内血管旁异常信号结节。左侧髂骨异常信号伴不均匀强化,存在转移的可能。
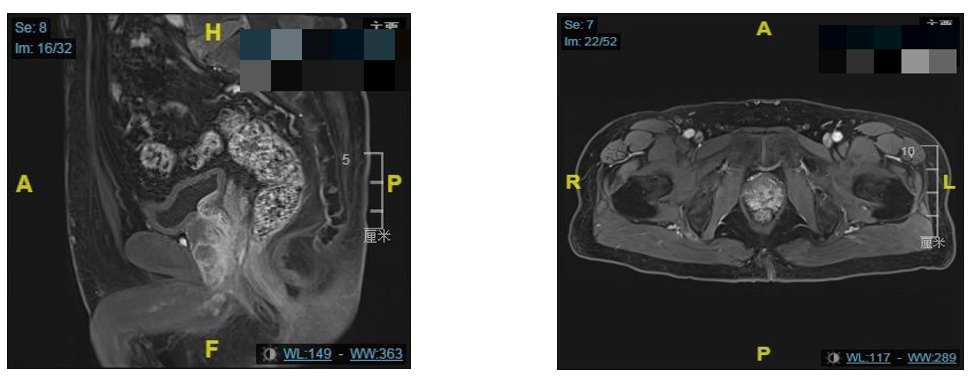
2017年2月复旦大学附属肿瘤医院MR资料
2017年2月复旦大学附属肿瘤医院行穿刺示:前列腺腺泡腺癌。
病例特点:
寡转移前列腺癌
初诊前列腺腺癌(cT2-3N0-1M1b)
骨转移病灶:n=2(T2,髂骨)
明显骨痛症状(PSI评分:6分)
转移性前列腺癌,
学界进行了哪些探索?
对于前列腺癌寡转移的治疗,临床重视局部病灶治疗的价值。2015年相关学者指出:对前列腺癌寡转移进行原发灶和转移灶的治疗,能减少新发转移病灶。
近些年,随着对寡转移前列腺癌局部治疗的认识进一步加深,学界发现肿瘤的转移不仅依赖肿瘤细胞,还需依赖肿瘤微环境。肿瘤病灶能释放出循环肿瘤细胞、树突状细胞及细胞因子等,促进肿瘤细胞发生新发转移。对原发灶进行手术、放疗等,在治疗局部病灶的同时,使得肿瘤远处转移病灶赖以生存的肿瘤微环境消灭。
既往多项回顾性分析显示,对寡转移前列腺癌原发灶进行手术治疗或放疗对比只接受系统性治疗的患者,OS延长。
此外,HORRAD研究是一项前瞻性随机对照研究,该研究将转移性前列腺癌患者分成2组,一组患者接受雄激素剥夺治疗(ADT),另一组患者接受ADT+原发灶放疗。结果显示,ADT+原发灶放疗组患者PSA进展时间延长,但OS未获得延长。
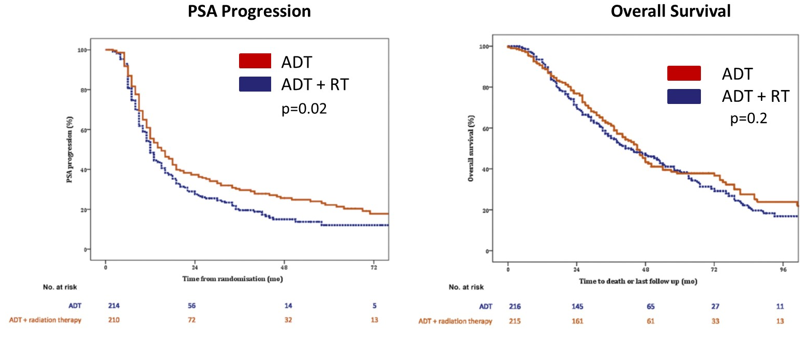
HORRAD研究ADT组和ADT+RT组患者PSA进展时间(左)和OS(右)
STAMPEDE研究是目前为止针对转移性前列腺癌患者进行原发灶放疗的最大规模的临床研究。这项研究纳入2061例初诊转移性前列腺癌患者,按照1:1的比例随机分为ADT组或ADT联合放疗组。研究结果显示,全组患者ADT联合放疗不能延长患者的OS(p=0.266);预先设定的亚组分析发现:在819名低转移负荷的患者中,ADT联合放疗可以延长患者的OS(HR=0.68;95%CI:0.52-0.90,p=0.007)。
全身治疗基础上手术治疗,
转移灶行SBRT
上述循证医学证据为近两年获得,时间回到2017年,彼时尚未有高级别循证医学证据支持转移性前列腺癌患者进行原发灶治疗。复旦大学附属肿瘤医院于2016年注册了一项寡转移性前列腺癌临床研究(OMPCa-Shanghai),该研究为一项开放、随机、对照的单用内分泌治疗对比局部治疗联合内分泌治疗对寡转移性前列腺癌长期疗效的前瞻性Ⅱ期临床研究。
这项研究纳入影像学检查发现存在转移病灶,转移病灶局限于淋巴结或骨骼,且转移病灶数≤5个,内分泌治疗开始时间在6个月内,前列腺癌原发病灶尚未接受过局部治疗的患者。寡转移性前列腺癌根治术的临床初步疗效观察及围手术期并发症分析显示,并发症风险并非寡转移性前列腺癌患者行前列腺癌根治术的限制因素,寡转移性前列腺癌患者行前列腺癌根治术治疗是安全、有效和可行的。
2020年欧洲肿瘤内科学会(ESMO)年会公布了这项长期随访结果。随访28个月后,对照组和治疗组的中位影像学无进展生存期(PFS)为50个月vs NE。
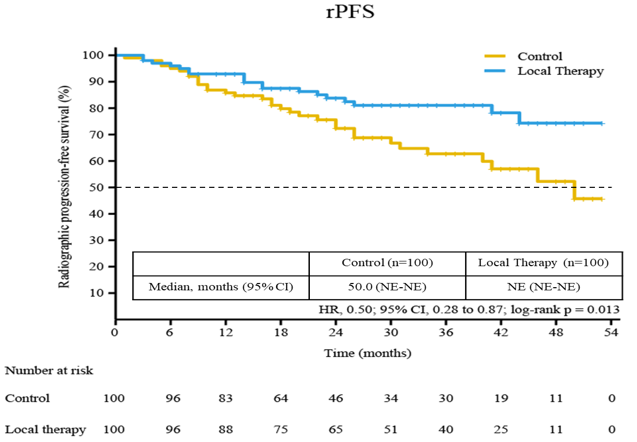
OMPCa-Shanghai研究两组患者影像学PFS
该患者经复旦大学附属肿瘤医院MDT会诊判断患者为寡转移前列腺癌,考虑到患者年纪相对较轻,基础疾病(高血压)控制良好,与患者充分交流前列腺原发病灶切除利弊之后,患者同意入组复旦大学附属肿瘤医院中心OMPCa临床研究。先行三个月内分泌治疗(比卡鲁胺+戈舍瑞林)联合双膦酸盐治疗,评估实施减瘤性前列腺切除手术。
2017年6月,MR检查示:前列腺病灶范围较前缩小,左侧精囊腺出血。左侧髂血管旁囊性结节较前缩小,存在左侧髂骨转移的可能。2017年6月25日,开放前列腺癌根治术。术后病理示:前列腺腺泡腺癌,癌细胞胞浆淡染,腺泡塌陷,内分泌治疗后改变显著。
2017年6月MR影像学资料
2018年1月,针对转移病灶进行立体定向放疗(SBRT)。第二胸椎和左侧髂骨,直线加速器放疗,单个总剂量为4000cGy。2018年6月,MR检查示:前列腺癌术后,局部目前未见明显复发征象,左侧髂骨异常信号灶伴强化,范围大致同前。随访至2019年9月,患者PSA有升高趋势。
2019年9月,MR检查示:前列腺癌术后,局部目前未见明显复发征象,左侧髂骨异常信号灶伴强化,范围大致同前。ECT示:T2未见异常放射性分布;原左侧骶髂关节处病灶放射性分布趋于正常。患者PSA持续升高,考虑为转移性去势抵抗性前列腺癌(mCRPC),给予停用比卡鲁胺,加用阿比特龙治疗。2019年9月至2021年12月,患者均疾病稳定,PSA维持于0.01-0.1之间,期间维持ADT+阿比特龙治疗。2021年9月,PSMA检测示:前列腺癌术后,骨转移灶放疗后,T2、左侧髂骨转移灶放射性分布趋于正常。
最后,戴波教授针对该病例进行了精彩总结:寡转移性前列腺癌处于临床局限和广泛转移的“中间”阶段,这类患者如根据传统疗法,接受全身系统性治疗,易出现耐药与疾病进展。如今,对于寡转移性前列腺癌的治疗理念已发生了根本性改变,患者在系统性治疗的基础上能达到疾病稳定,则有必要针对原发病灶进行包括放射治疗、手术治疗在内的局部治疗。目前,亦有越来越多的循证医学证据支持对转移灶进行放疗。至今,患者OS已超过5年。

本文首发:医学界肿瘤频道
本文作者:大力
责任编辑:Sweet
| 留言与评论(共有 0 条评论) “” |