*仅供医学专业人士阅读参考
2022 ASCO驱动基因阳性IV期肺癌治疗指南更新
近日,美国临床肿瘤学会(ASCO)年会盛大召开,会议对2021年联合加拿大安大略省癌症护理协会(OH/CCO)发布的包括IV期非小细胞肺癌系统治疗在内的临床实践指南做出了更新。本文关注了驱动基因阳性的IV期NSCLC治疗领域,重点关注了2项研究,其为本次指南更新提供了有力的证据支持,也为临床实践提出了新的诊疗药物。

指南发表截图
ALK阳性的NSCLC患者再添新选择
01
对于ALK重排和既往未经治疗的NSCLC患者,最有效的治疗方法是什么?
本次ASCO指南针对临床问题3(原指南的Clinical Question 3)的回答新增加了一项一线治疗药物——洛拉替尼。新版指南在建议3.1中明确表明,对于ALK基因重排,PS为0-2且先前未经治疗的NSCLC患者,临床医生应提供艾乐替尼或布加替尼(基于循证证据;利大于弊;证据质量:高;推荐强度:强推荐)或洛拉替尼(基于循证证据;利大于弊;证据质量:低;推荐强度:弱)。见图1。

图1
洛拉替尼是间变性淋巴瘤激酶(ALK)的第三代抑制剂,早在2018年9月和同年11月就基于临床的I/II期成果[1],先后于日本和美国获批上市,本次被列入ASCO治疗IV期NSCLC的指南中,主要基于一项CROWN的III期临床随机对照试验。研究发表见图2。

图2.CROWN研究发表截图
该研究是一项III期临床的RCT,头对头比较了洛拉替尼和克唑替尼的临床疗效。研究纳入既往均未接受过治疗的晚期ALK阳性NSCLC成年患者,PS评分为0-2,以1:1的比例随机分为两组,分别接受洛拉替尼100mg/天或克唑替尼250mg/天的治疗;主要结局指标为由盲法独立中心评价的无进展生存期(PFS)或任何原因死亡的时间,次要结局指标为研究者评估的PFS、总生存期(OS)、客观缓解、客观颅内缓解和安全性评价结果(AE)。
最终纳入洛拉替尼组149例,克唑替尼组147例,克唑替尼组中有5名患者未接受治疗,被纳入意向治疗分析人群(ITT)。研究结果显示,洛拉替尼组PFS的中位随访时间为18.3个月,克唑替尼组为14.8个月;洛拉替尼组在12个月时存活且无疾病进展的患者占比为78%(95%CI 70%-84%),而克唑替尼组为39%(95%CI 30%-48%)(HR 0.28;95%CI 0.19-0.41;P<0.01)。见图3A。
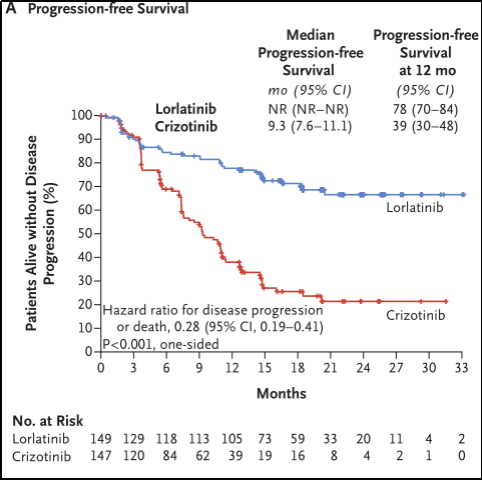
图3A.无进展生存期
在ITT分析中,洛拉替尼的中枢神经系统(CNS)进展时间明显长于克唑替尼。洛拉替尼组12个月无CNS进展的存活患者百分比为96%(95%CI 91%-98%),克唑替尼组为60%(95%CI 49%-69%)(HR 0.07;95%CI 0.03-0.17)。见图3B。
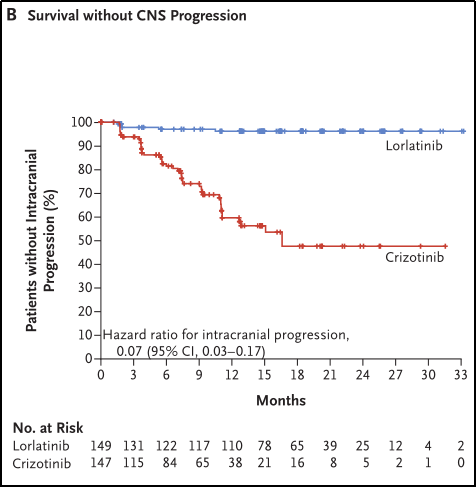
图3B.无CNS进展的生存期
12个月时,洛拉替尼组首次发生CNS进展的累积发生率为2.8%(95%CI 1.0%-8.1%),而克唑替尼组为33.2%(95%CI 24.6%-44.7%)(HR 0.06;95%CI 0.02-0.18)。见图3C。

图3C.首次发生CNS进展的累积发生率
数据截止时,在ITT人群中共有51例死亡(洛拉替尼组23例,克唑替尼组28例),组间OS差异不显著(HR 0.72;95%CI 0.41-1.25)。见图3D。
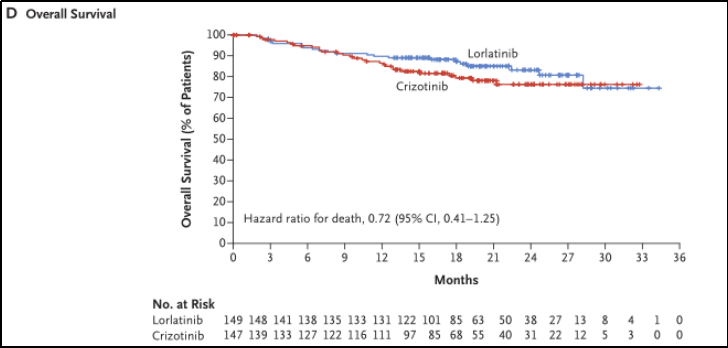
图3D.总生存期
洛拉替尼组和克唑替尼组发生3或4级AE的比例分别为72%和56%。其中洛拉替尼组最常见的不良反应为为甘油三酯水平升高、体重增加、胆固醇水平升高和高血压,克唑替尼组最常见的为AST、ALT水平升高。两组严重AE的发生率分别为34%(洛拉替尼组)和27%(克唑替尼组);共有14例患者发生致命不良事件,两组各见7例。
综上所述,第三代ALK抑制剂洛拉替尼和第一代抑制剂克唑替尼相比,其PFS明显延长,但OS无明显差异(见图3A、3D)。
尽管有证据显示洛拉替尼对ALK阳性的IV期NSCLC患者有效,且本次指南将其列入该类患者一线治疗的选择,但临床医生使用时需对其明确的不良反应加以重视,尤其是认知改变和情绪障碍(不论任何等级),以及甘油三酯水平升高、体重增加、胆固醇水平升高和高血压等。
RET重排:普拉替尼又添新证据
02
对RET重排患者最有效的治疗方法是什么?
此次ASCO指南更新,将2021年针对临床问题11(原指南的Clinical Question 11)的建议11.1和11.3重组,指出“对于RET重排、PS为0-2且既往未治疗的NSCLC患者,临床医生可提供Selpercatinib或普拉替尼(证据类型:非正式共识;证据质量:低;推荐强度:中等),将普拉替尼与Selpercatinib作为并列证据推荐。见图4。

图4
03
对于IV期NSCLC伴RET重排PS 0-2的患者,最有效的二线治疗是什么?
将临床问题12(原指南的Clinical Question 12)的建议12.2和12.3重组,建议“对于未接受RET靶向治疗的RET重排患者,临床医生可提供Selpercatinib(非正式共识;证据质量:低;推荐强度:中等)或普拉替尼(非正式共识;证据质量:低;推荐强度:弱)”,将普拉替尼与Selpercatinib并入建议12.2。见图5。

图5
普拉替尼是由基石药业开发的一款高效口服选择性RET抑制剂,最早在2020年基于ARROW的一项研究结果而先后被FDA加速批准用于NSCLC和甲状腺癌[2],于2022年3月24日也经我国国家药监局批准上市。此次普拉替尼在ASCO指南临床问题11和12上被提到“前排”,同样是基于这项ARROW的队列研究。见图6。

图6.ARROW研究发表截图
该研究是一项多队列、开放标签、1/2期研究,目前文献仅报道了2期试验的完整研究结果:
研究纳入年龄≥18岁,患有局部晚期或转移性实体瘤且RET融合阳性、PS为0-2(后方案修正为0-1)的患者;在2期试验中,患者均接受口服普拉替尼400mg/日的治疗。
2期试验的主要结局指标为客观缓解率(ORR)和安全性评价结果;次要结局指标为缓解持续时间(DoR),临床获益率[CR/PR/疾病稳定(SD)持续≥16周的患者比例],疾病控制率(DCR,CR/PR/SD的患者比例),颅内肿瘤缓解率,PFS和心电图。
研究结果显示,在先前接受过铂类化疗的患者中(87例):
87名患者中疾病发生缓解者共53例(61%;95%CI 50%-71%),其中CR者5例;疾病控制率为91%(95%CI 83%-96%),临床获益率为69%(95%CI 58%-79%),见图7;

图7
首次缓解的中位时间为1.8个月(IQR 1.7-1.9),从首次缓解到中位随访时间12.9个月时,中位DoR未达到(95%CI 15.2-不可估计),见图8;

图8
1.在中位随访时间为14.7个月(IQR 12.7-18.4)时,中位PFS为17.1个月(95%CI 8.3-22.1),42名患者出现疾病进展或死亡,见图9;
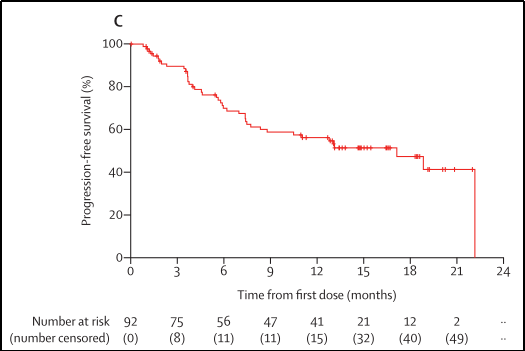
图9
2.在中位随访时间17.1个月时,中位OS未达到(IQR 14.6-20.3),25名患者死亡;
3.83名患者中的79名患者观察到肿瘤较基线水平时缩小。
既往未接受过治疗的患者中(27例):
1.27名既往未经治疗的患者中有19名疾病出现缓解(70%;95%CI 50%-86%),其中CR者3例;疾病控制率为85%(95%CI 66%-96%),临床获益率为70%(95%CI 50%-86%),见图7;
2.在中位随访时间为10.2个月(IQR 7.8-11.8)时,所有缓解患者的中位DoR为9.0个月(95%CI 6.3-不可估计),见图10;
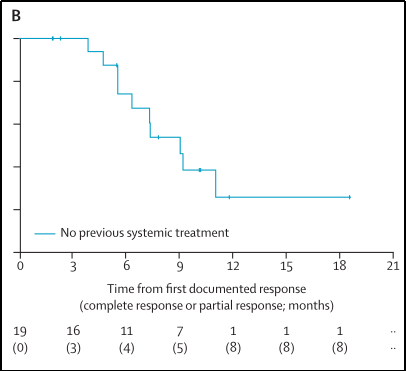
图10
3.在中位随访时间为11.6个月(IQR 11.0-17.3)时,中位PFS为9.1个月(95%CI 6.1-13.0),17名患者出现疾病进展或死亡,见图11;
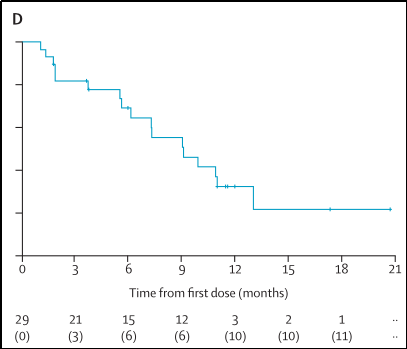
图11
4.中位随访时间为13.6个月(IQR 13.0-17.6)时,中位OS未达到,死亡者5例。
安全性方面,233名患者中有216例出现了治疗相关的AE,最常见是中性粒细胞减少,高血压和贫血;报告了55例严重的治疗相关的AE,最常见的有肺炎、贫血和中性粒细胞减少。见图。
总而言之,ARROW的研究表明,无论既往是否接受过铂类治疗,普拉替尼在RET融合阳性的NSCLC患者中具有良好的耐受性和持久的临床活性(包括颅内活性)——在既往接受过铂类化疗的患者中ORR为61%,中位PFS为17.1个月,而在既往未接受过治疗的患者中ORR为70%,中位PFS为9.1个月。
有研究显示NSCLC患者中驱动基因阳性者占比达73.9%[3],目前已发现的驱动基因靶点除上文提到的ALK、RET外,还有EGFR、ROS1、NTRK和MET等,此类患者多应用靶向治疗大大延缓了疾病的进展。然而,耐药性是靶向治疗不可避免的一个挑战,研究人员也在不断开发新的药物试图解决这一问题,如ALK抑制剂由一代的克唑替尼,到后来出现的艾乐替尼、布加替尼,发展到现在的三代洛拉替尼。
未来,肿瘤的治疗可能会转向多种疗法组合的方案(如目前的一个热点话题免疫疗法联合靶向治疗)[4]。本指南的更新意味着医学界在驱动基因阳性NSCLC的精准治疗上获得了新一步进展,就目前而言,开发更有效的药物对于提高驱动基因阳性患者的存活率来说仍至关重要。
参考文献:
[1]Syed YY.Lorlatinib:First Global Approval.Drugs.2019 Jan;79(1):93-98.doi:10.1007/s40265-018-1041-0.PMID:30604291.
[2]Kim J,Bradford D,Larkins E,et al.FDA Approval Summary:Pralsetinib for the Treatment of Lung and Thyroid Cancers With RET Gene Mutations or Fusions.Clin Cancer Res.2021 Oct 15;27(20):5452-5456.doi:10.1158/1078-0432.CCR-21-0967.Epub 2021 May 27.PMID:34045295.
[3]Wen S,Dai L,Wang L,et al.Genomic signature of driver genes identified by target next-generation sequencing in Chinese non-small cell lung cancer.Oncologist,2019,24(11):e1070-e1081.doi:10.1634/theoncologist.2018-0572
[4]Tian X,Gu T,Lee MH,Dong Z.Challenge and countermeasures for EGFR targeted therapy in non-small cell lung cancer.Biochim Biophys Acta Rev Cancer.2022 Jan;1877(1):188645.doi:10.1016/j.bbcan.2021.188645.Epub 2021 Nov 15.PMID:34793897.
你想要的肿瘤指南内容
敬请关注医生站
留言与评论(共有 0 条评论)
“”