*仅供医学专业人士阅读参考

导语
“ADC 45分钟”开播,马飞、张剑和欧阳取长,三位教授带您详细领略乳腺癌ADC药物的现有格局和未来展望。
近年来,ADC药物的发展备受关注,作为肿瘤领域的热门赛道,ADC药物一直备受关注。由北京科创医学发展基金会主办,阿斯利康和医学界传媒等共同支持的访谈学术栏目—“ADC 45分钟”在ADC Academy平台重磅开启,该项目旨在邀请国内外知名专家聚焦ADC药物,解析前沿热点,探讨ADC药物的当下和未来。
2022年7月20日,“ADC 45分钟”第一期正式开启,特邀中国医学科学院肿瘤医院马飞教授、复旦大学附属肿瘤医院张剑教授、湖南省肿瘤医院欧阳取长教授共同参与,聚焦ADC药物的现在和未来,解析HER2、Trop2和其他新型靶点ADC药物在乳腺癌治疗中的前沿热点。
马飞教授在开场中提到:“ ADC药物已经取得了巨大的成功,这些年在各种学术大会上,都有ADC药物的精彩结果分享。目前全球已有14款ADC药物获批上市(截至2021年年底),其中包括3款乳腺癌治疗领域的ADC药物。而从2020年第一款ADC药物进入中国以来,国内已经有5款ADC药物获批抗肿瘤治疗适应症,并即将迎来第6款ADC药物的获批。不仅如此,中国还有很多自主研发的ADC药物正处于蓬勃发展之中。”总体来说,ADC药物已经成为当前的关注热点。
现有ADC药物对乳腺癌治疗的影响
马飞教授前情提要:ADC药物结合了化疗的高效性和靶向药的特异性,既克服了传统化疗毒性大,治疗窗窄的局限性,同时也大幅提高了靶向药物的抗肿瘤效果。目前乳腺癌领域先后上市的3款ADC药物T-DM1、DS-8201、SG都在各自III期临床研究中取得了重大突破,基于目前的研究数据,如何看待当前它们在乳腺癌中的治疗地位?随着国内获批上市,将对乳腺癌治疗的临床格局产生什么影响?
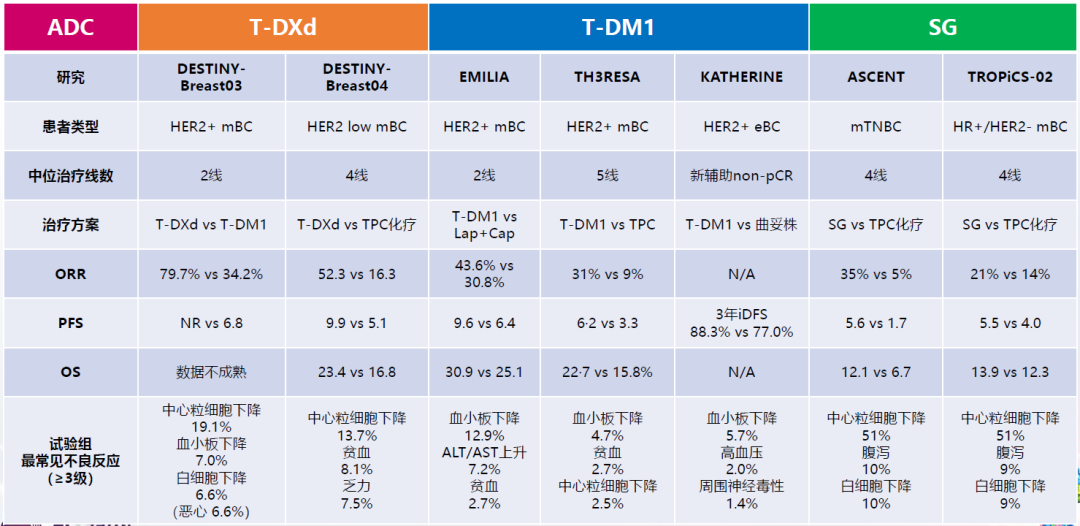
张剑教授:早期的EMILIA研究中,T-DM1为HER2阳性晚期乳腺癌带来了9.6个月的中位无进展生存期(PFS),奠定了其长达10年的二线标准治疗地位。但是后期研究探索中,并没有成功将T-DM1引入到新辅助治疗、单纯的辅助治疗以及晚期一线治疗领域。尽管存在缺憾,但这也给未来的研究探索提供了空间。DS-8201相较于T-DM1具有更加优化的结构设计,而得益于这种优势,DS-8201在与T-DM1的头对头临床研究DESTINY-Breast03中大获全胜,研究者评估的中位PFS达到25.1个月。目前DS-8201在国外已经获批二线治疗适应症,相信不久之后,也会成为国内HER2阳性晚期乳腺癌二线治疗的重要选择。
SG是TROP-2靶向ADC药物,ASCENT研究证实了SG在晚期三阴性乳腺癌(TNBC)≥2线治疗中具有较好的疗效,目前也已经在国内获批上市。后续在实际发挥作用的过程中,还观察到一些原有性质的衍生,因而SG在跨分型乳腺癌中的一些研究探索也越来越受到关注, 其中就包括评估SG在HR+/HER2-乳腺癌后线治疗中取得显著获益的TROPiCS-02研究。
总体而言,目前已经获批的这些ADC药物基于其良好的疗效和安全性,具有较高的净获益率。此外,这些ADC药物之间可能还存在序贯治疗的可能性,从而促使现有治疗格局进一步发生转变,但未来究竟如何为患者制定最佳治疗次序,可能需要更多研究数据的支持。
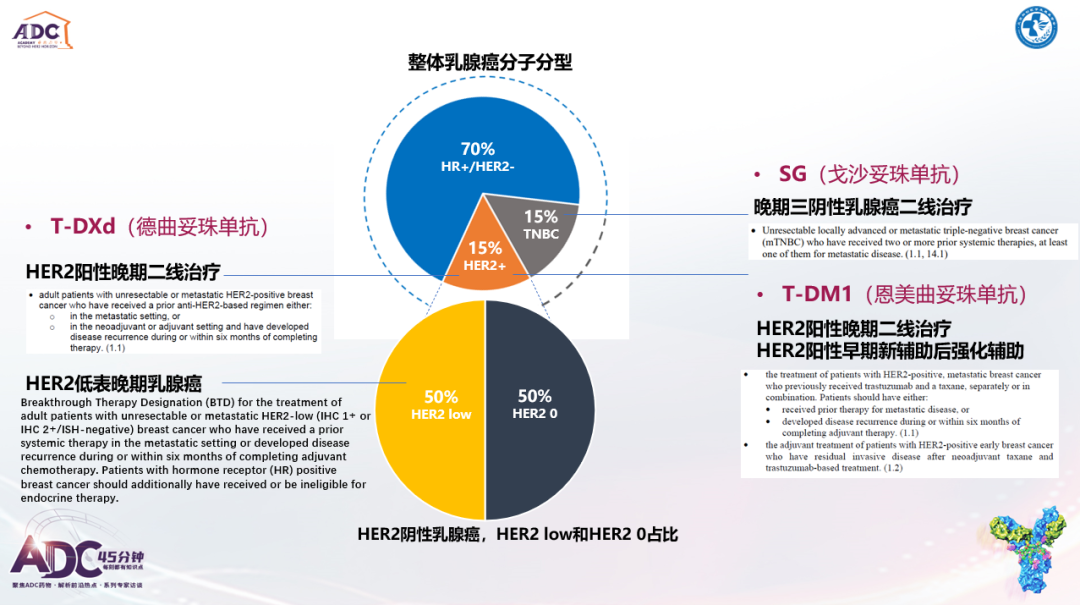
欧阳取长教授:ADC药物实现了肿瘤科医生精准化疗的梦想,是一类具有高水平设计理念的抗肿瘤药物,目前DS-8201和SG是乳腺癌治疗中最受关注的ADC药物。在HER2阳性乳腺癌治疗领域,基于DB03研究的重磅成果,DS-8201已经彻底取代了的T-DM1的二线治疗地位,诸如ESMO、NCCN、ABC、ASCO等指南已经将其作为二线优选推荐。在国内吡咯替尼也是标准的二线治疗选择,能将HER2阳性晚期乳腺癌患者的中位PFS延长至12.5个月,虽然缺乏头对头研究,但是从数值上看,DS-8201二线治疗可能具有更大的优势,不过孰优孰劣仍需进一步的研究验证。未来ADC药物的相关研究中将吡咯替尼联合卡培他滨作为对照组,将是值得探索的方向。
SG在IMMU-132-01、ASCENT研究中已经展现出针对晚期TNBC的良好效果,也由此获得了国内外指南的共同推荐。鉴于TROP-2靶点在不同类型乳腺癌中的广泛分布,提示了SG治疗其他乳腺癌的可能性。这在今年ASCO大会公布的TROPiCS-02研究中就得到了充分体现,结果显示SG相比医生选择的化疗针对HR+/HER2-乳腺癌具有显著获益。
需要指出的是,HER2低表达在总体乳腺癌中的占比约为50%,基于DESTINY-Breast04(DB04)研究成果,DS-8201有望成为首个针对HER2低表达乳腺癌的靶向治疗药物,目前2022年NCCN指南V4版、2022年ASCO HER2阴性乳腺癌治疗指南已经将DS-8201治疗HER2低表达乳腺癌纳入了治疗推荐,由此奠定了HER2低表达作为新的临床治疗分型的重要地位,而DS-8201也由此将成为首款针对HER2低表达乳腺癌的标准治疗药物。并且,鉴于HER2低表达广泛分布于TNBC和HR+/HER2-乳腺癌,这意味着DS-8201有望实现所有分型乳腺癌患者的全覆盖。
ADC药物的设计和结构的差异
马飞教授前情提要:ADC药物与传统的同类靶向药物相比,显得更加复杂且相互之间可能存在较大差异,而药物设计和结构等方面的不同决定了其临床疗效和安全性的区隔,能否分析乳腺癌治疗领域现有三大ADC药物在药物设计和结构上的差异,并谈谈对于这些药物序贯使用的思考。
张剑教授:在药物设计方面,靶点的选择很重要,首先就要满足在肿瘤组织和正常细胞表面差异化表达的特点,不然除了ADC药物主要的非靶点毒性之外,还会产生靶点依赖性毒性。比如TROP-2靶点,除了在肿瘤细胞表面高表达之外,在包括胃肠道、尿路上皮组织等也有一定程度的表达,相应靶点ADC药物的不良反应值得关注。
其次对于连接子,从一代、二代已经升级到三代甚至超三代,可分为可裂解和不可裂解连接子。既往ADC药物的设计中,为避免脱靶毒性,希望连接子越稳定越好,但是不可裂解连接子虽然极其稳定,相应ADC药物却并不具备旁观者效应,因而其抗肿瘤杀伤作用略显逊色。而在现行设计中,往往希望ADC药物被内吞之后,释放出的载药能够穿透细胞膜发挥旁观者效应,进一步增强抗肿瘤活性,这就需要满足连接子可裂解,同时还具有足够稳定性的技术条件。
第三,大多数ADC药物的载药为微管蛋白抑制剂如T-DM1等,DS-8201和SG的载药为拓扑异构酶I抑制剂,其他载药类型还包括DNA损伤剂等。ADC药物偶联不同作用机制的载药,能避免交叉耐药性,也是其在抗肿瘤序贯治疗中非常重要的考量因素。拓扑异构酶I抑制剂的抗肿瘤活性在目前的载药中偏向中等,通过特殊的设计以及提高DAR值来强化其治疗效果,并且实现脱靶毒性和高DAR的平衡。DS-8201的载药活性是SN38的10倍,并且得益于连接子结构的优化,其DAR达到理论高值的同时,并未增加体内清除率,且脱靶毒性也极低,是目前具有标杆性结构设计的新型ADC药物。
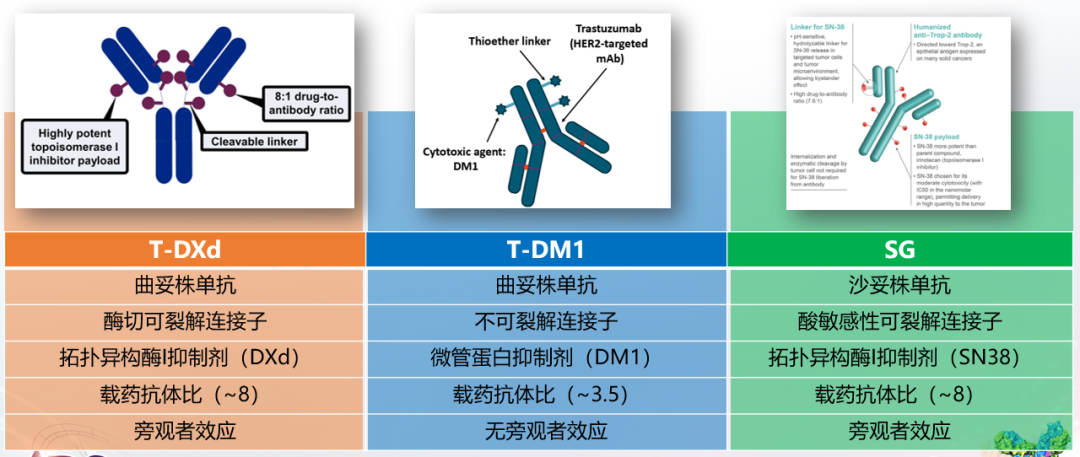
欧阳取长教授:ADC药物相比传统化疗和单克隆抗体具有更强效的抗肿瘤活性,在既往经过多种抗HER2靶向治疗、化疗、内分泌治疗甚至CDK4/6抑制剂治疗进展后的乳腺癌中仍能取得显著获益。并且现有研究也体现出不同ADC药物序贯使用的可能性,但是未来乳腺癌治疗中T-DM1、DS-8201、SG如何排兵布阵,仍需要进一步的研究设计去验证。
ADC药物在乳腺癌的研究布局
及可能的治疗格局变化
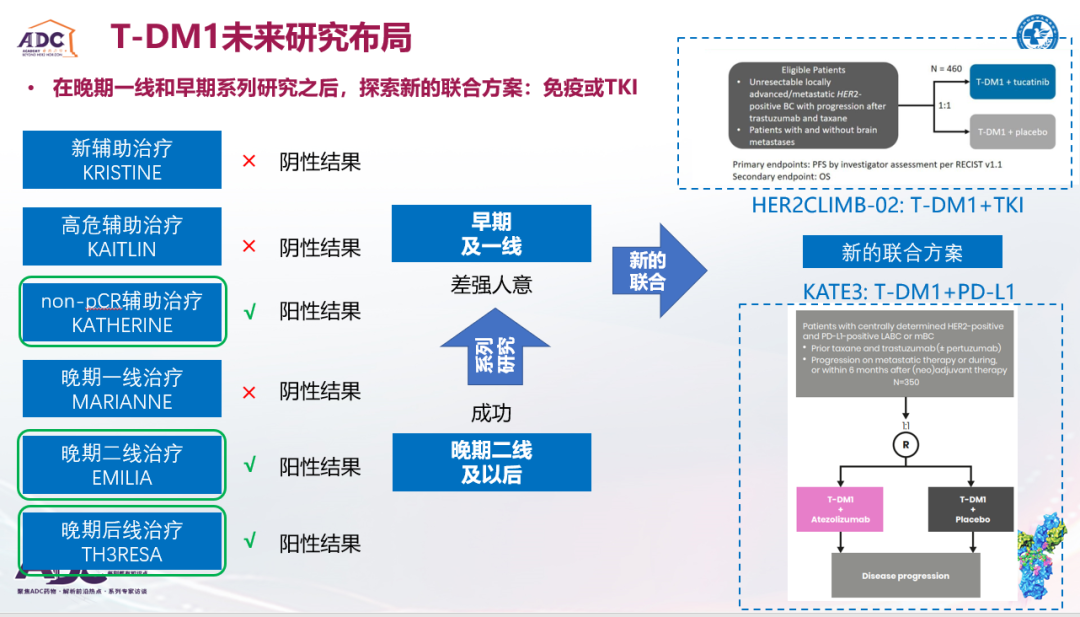
马飞教授前情提要:ADC药物为乳腺癌的治疗带来了巨大惊喜,并且还一直处于持续探索的过程中。例如T-DM1在HER2阳性晚期乳腺癌的后线、二线治疗中取得成功之后,在晚期一线和早期乳腺癌治疗领域也开展了一系列探索,但是晚期一线、新辅助、辅助治疗研究大多以失败告终。随后又尝试了各种联合治疗布局,包括联合小分子酪氨酸激酶抑制剂(TKI)或者联合免疫治疗等,以期进一步拓展其治疗适应症。
DS-8201也进行了广泛的研究布局:晚期后线(DB01)和二线(DB03)治疗取得成功;积极布局晚期一线(DB09)和早期新辅助(DB11)及强化辅助治疗(DB05);同时,HER2低表达在后线(DB04)治疗中取得成功,也会往更前线进行探索,并在寻找HER2低表达的边界从而更好的定义获益人群。DS-8201的另一个方向也是探讨联合用药,诸如DB07、DB08和HER2CLIMB-04、BEGONIA等研究均提示了以DS-8201为基础的各种联合治疗策略的巨大潜力。
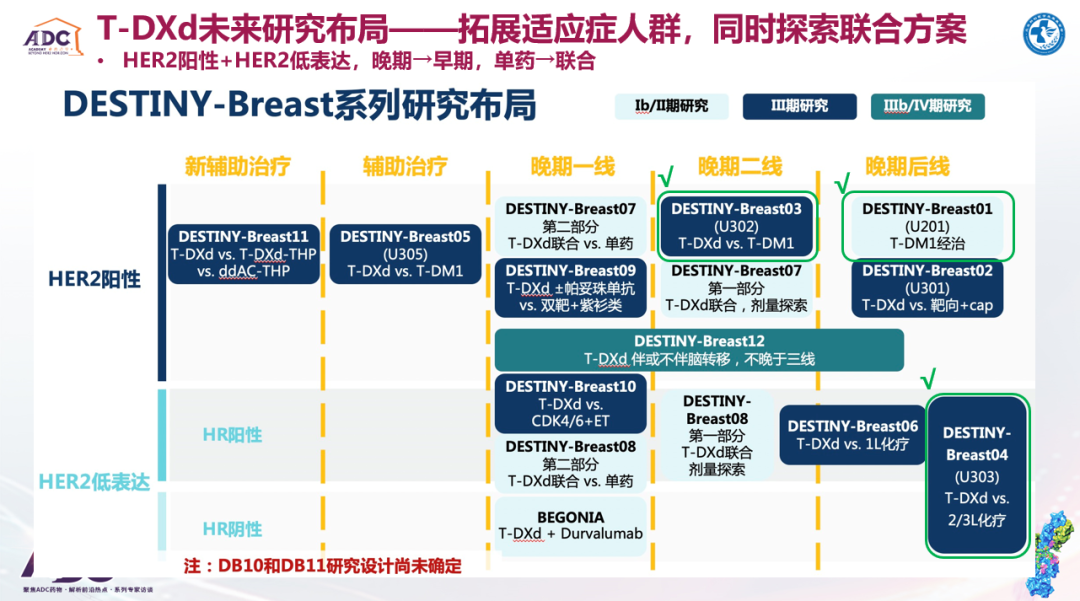
SG在全球多中心的研究探索也在持续进行,不仅获批了治疗晚期TNBC(≥2线)的适应症,并且还将治疗线数前移至TNBC晚期一线以及早期新辅助/辅助治疗阶段。此外,在HR+/HER2-乳腺癌的早期辅助和晚期后线治疗中也有布局。
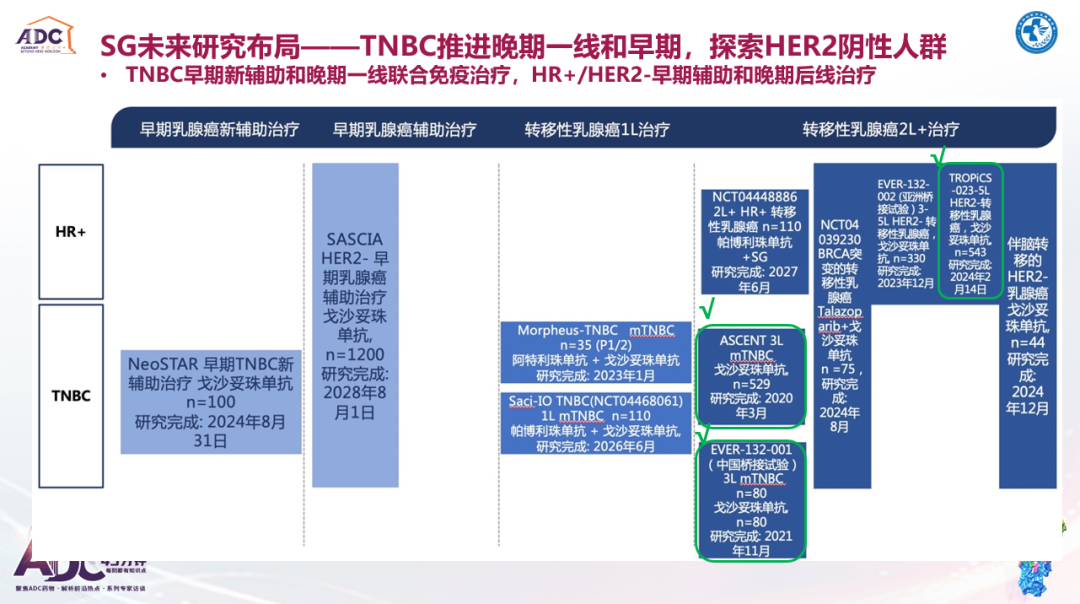
如果上述ADC药物的相关研究均取得成功,乳腺癌的治疗格局又会发生什么变化?
张剑教授:T-DM1除了应用于强化辅助、晚期二线和三线治疗之外,还在乳腺癌治疗领域进行了很多其他尝试,但基本上铩羽而归。进一步分析发现,在这些研究探索中可以观察到特定的获益人群,提示相关研究的目标患者中,T-DM1可能在特定的应用场景中发挥效应。
不过整体而言,T-DM1在乳腺癌治疗领域的全线布局可能不如DS-8201。比如DB06研究将证实HER2极低表达乳腺癌患者接受DS-8201治疗有效,研究成果拭目以待。探索晚期一线治疗获益的DB09研究预期也是阳性成果,这意味着DS-8201将与标准的晚期一线治疗方案--曲帕双帕联合化疗(HPK)分庭抗礼。不仅如此,DS-8201在包括新辅助治疗以及辅助治疗领域也极大可能交出满意答卷,部分取代HPK和T-DM1。这些都说明,随着DS-8201更多研究数据的公布,乳腺癌领域将会迎来新一轮的治疗变革,并且相应的现有药物应如何排兵布阵可能会成为热点。
关于SG在TNBC晚期一线的治疗探索,联合免疫可能有所突破;在新辅助治疗领域,2022 年ASCO大会公布的NeoSTAR研究数据还有提升空间,后期研究探索应在既往标准治疗基础上加以改进,以进一步提高治疗获益,目前邵志敏教授团队正在开展相关工作。SG在乳腺癌辅助治疗中的应用前景可能不如DS-8201那么明朗,未来能否针对TROP-2富集表达的人群做一些特殊的考量,值得期待。
总体而言,这三个ADC药物在各自临床应用场景中均取得了一些成就,希望未来能再创佳绩,并精选到获益优势人群,将预期获益进一步放大,得到超预期的结果,更大程度造福于乳腺癌患者。
欧阳取长教授:DS-8201在药物设计上全面超越T-DM1,并且从目前的DB03研究数据上看,也是完全碾压T-DM1,这些都支持了DS-8201在HER2阳性乳腺癌早期辅助治疗研究DB05中再次获得阳性结果的可能性。此外,DS-8201挑战HER2阳性乳腺癌晚期一线标准治疗的DB09研究,目前也在国内各大中心如火如荼地开展,研究进度远超预期。这些都提示,在不久的将来,DS-8201有望再次对乳腺癌的现有标准治疗产生压倒式的冲击,充分展现出DS-8201巨大的治疗潜力。
ADC药物的未来期待
马飞教授前情提要:ADC新药层出不穷,在多个治疗靶点上都有积极探索。但目前ADC药物的很多临床研究尚未公布结果或仅公布临床初期结果,甚至还有很多创新药物正处于初步的早期探索中,据此谈谈未来对于ADC药物还有哪些期待?
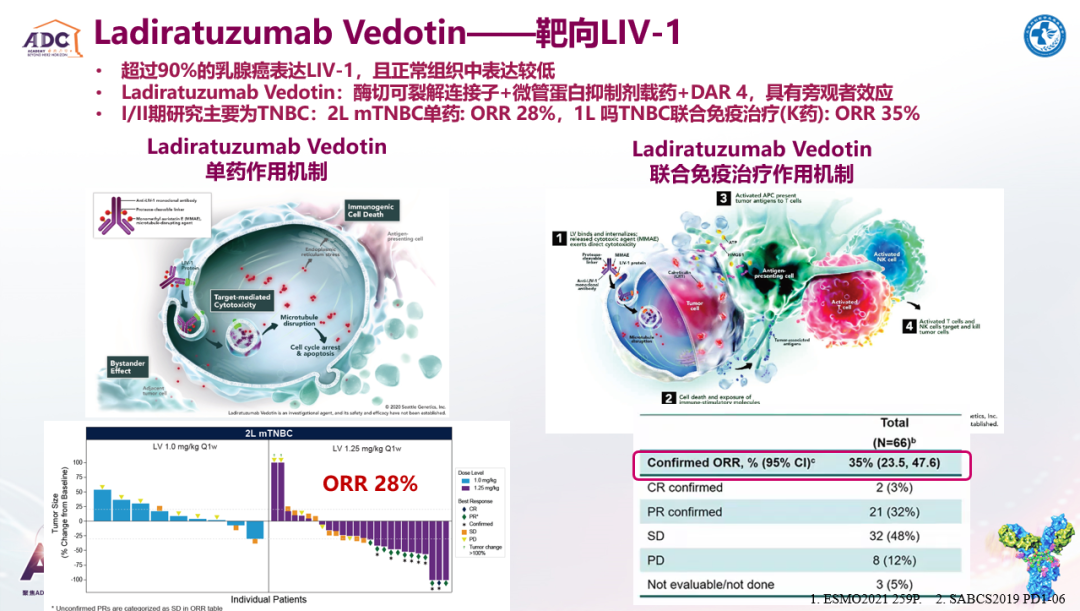
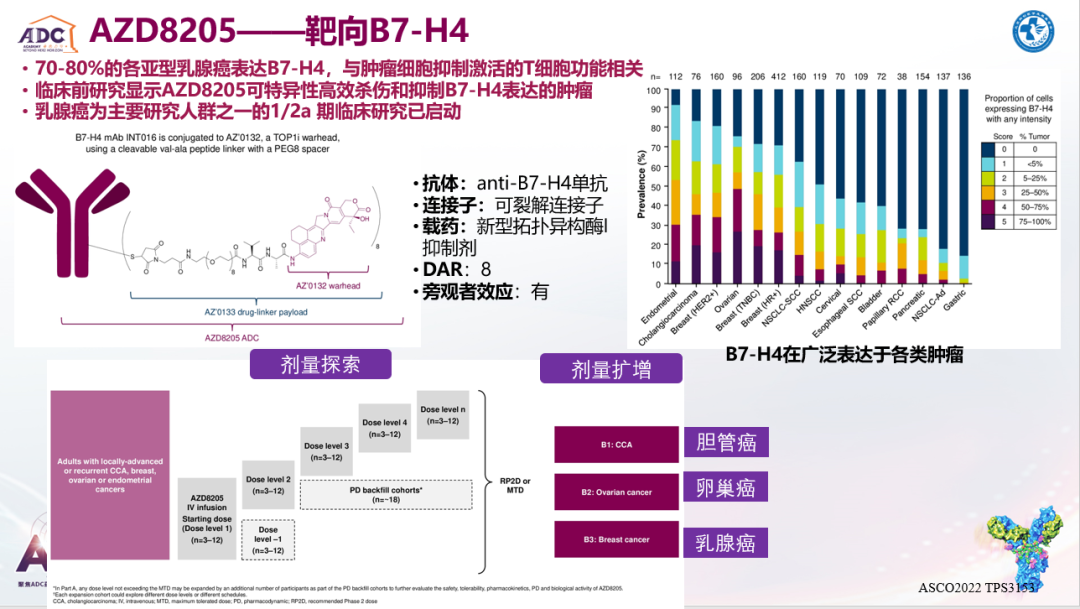
张剑教授:未来ADC的研发方向,除了HER2、TROP-2这些已确立ADC药物的研发靶点之外,诸如LIV-1、HER3、B7-H3、B7-H4等靶点正在积极开发中。这其中比较关键的点在于,靶点在肿瘤细胞表面特异性高表达,而在正常组织中较低表达,从而降低ADC药物的靶点依赖性毒性。目前仅在TNBC中就已报道有10多种靶点的ADC药物正在开发中。另外,在新药设计方面,载药也可以具有肿瘤特异性,从而降低ADC药物发挥旁观者效应时可能产生的毒副作用。

欧阳取长教授:未来寻找针对不同靶点的抗体和高活性载药是ADC药物的研发热点。并且基于HER3、LIV-1、B7-H4靶向ADC药物取得的相关进展,未来HER3-DXd(HR+/HER2-和HER2+以及TNBC患者)和Ladiratuzumab vedotin(HR+/HER2-和TNBC患者)有望成为不同分型晚期乳腺癌的后线治疗。并且AZD8205在TNBC中的治疗潜力也值得期待。另外,不同靶点ADC药物能否序贯甚至联合使用也是未来值得探讨的方向。



总结
乳腺癌的ADC药物治疗时代已然到来,以DS-8201、SG、T-DM1为代表的ADC药物,全面布局不同分型乳腺癌治疗领域,基于现有成果,将乳腺癌治疗获益提升到全新高度。并且更进一步的研究探索正在大量的开展,有望解答更多乳腺癌治疗难题。与此同时,ADC药物可谓多靶点开花,诸如HER3、B7-H4、LIV-1等靶向ADC药物在HR+/HER2-、HER2+、TNBC治疗领域也崭露头角,为乳腺癌后线治疗提示了重要方向。相信未来,随着研究的深入,乳腺癌ADC治疗领域将会呈现出百花齐放、满园春色的可喜局面,为更多乳腺癌患者带来治疗希望。

ADC Academy Online
由北京科创医学发展基金会主办,聚焦于抗体偶联药物的学术交流平台。平台紧跟相关领域的最新进展,致力于促进相关专业人士的科学交流和继续医学教育。
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |