在今年WCLC会议上,IMpower010研究公布辅助免疫治疗的最新重磅OS数据!
作为肺癌免疫治疗的下一个“风口”,PD-1/L1抑制剂在早期非小细胞肺癌(NSCLC)患者围手术期治疗中的应用备受关注。OS作为评估抗肿瘤药物疗效的金标准,一直是免疫新辅助/辅助治疗研究重点关注的疗效指标。
在最近召开的2022年世界肺癌大会(WCLC 2022)上,作为首个证实辅助免疫治疗获益的临床III期关键研究IMpower010,正式公布了预设的首次OS中期分析结果,这也是辅助免疫治疗首次报告OS相关数据。如何看待这项重磅数据的意义,以及对辅助免疫治疗的影响?“医学界”就此特邀IMpower 010研究者之一、同济大学附属上海市肺科医院周彩存教授,解读最新出炉的IMpower010研究OS数据,并探讨辅助免疫治疗的应用前景。
IMpower010研究OS获益明显,
辅助免疫治疗前途光明
IMpower010研究既往公布的数据主要是无病生存期(DFS)的结果,研究显示阿替利珠单抗辅助治疗,用于PD-L1肿瘤细胞(TC)表达≥1%,且经手术切除和以铂类为基础辅助化疗后的II-IIIA期患者,具有显著的DFS获益,患者疾病复发或死亡风险降低34%(DFS HR=0.66,P=0.004),治疗组患者的3年DFS率达到60%[1]。基于以上数据,阿替利珠单抗已在中国、美国和日本等国获批辅助治疗适应证。
周彩存教授表示,“IMpower010研究作为早期NSCLC辅助免疫治疗的标志性临床研究,是一项划时代的,改变了临床实践的研究。作为首个证实且目前唯一获批辅助免疫治疗适应症的III期研究,阿替利珠单抗开启辅助免疫治疗新纪元。同时也获得了美国国立综合癌症网络(NCCN)、美国临床肿瘤学会(ASCO)和中国临床肿瘤学会(CSCO)等权威指南的推荐。”
在IMpower010研究达到DFS方面的主要终点后,作为关键次要终点的OS数据,就备受临床工作者期待。本次WCLC公布的数据,则是IMpower010研究计划开展的首次OS中期分析结果,患者中位随访时间为45.3个月(截至2022年4月18日)。
周彩存教授解读到,首先在PD-L1 TC≥1%的II-IIIA期患者中,阿替利珠单抗辅助治疗组有明显的OS获益趋势(HR=0.71,95%CI:0.49-1.03),治疗组患者的3年OS率为82.1%,5年的OS率为76.8%,生存曲线图上也已经与对照组呈较为明显的分离态势(图1)。
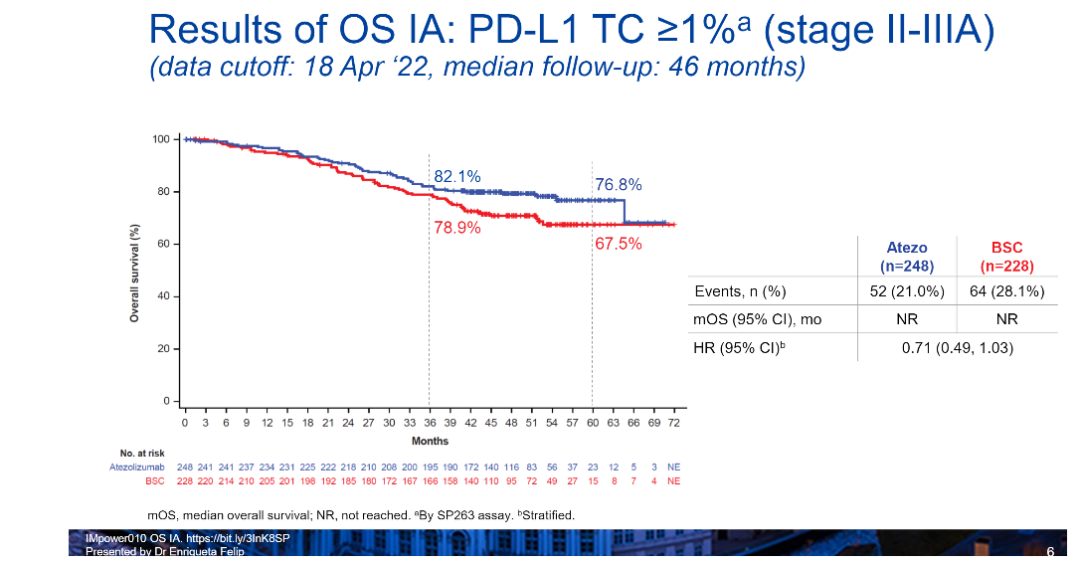
图1.PD-L1 TC≥1%的II-IIIA期患者OS数据
值得注意的是,在PD-L1 TC≥50%的II-IIIA期患者中,阿替利珠单抗治疗的OS获益更为突出(HR=0.43,95%CI:0.24-0.78),治疗组患者3年的OS率为89.1%,5年的OS率为84.8%,5年OS率较对照组提高了近20%(图2)。
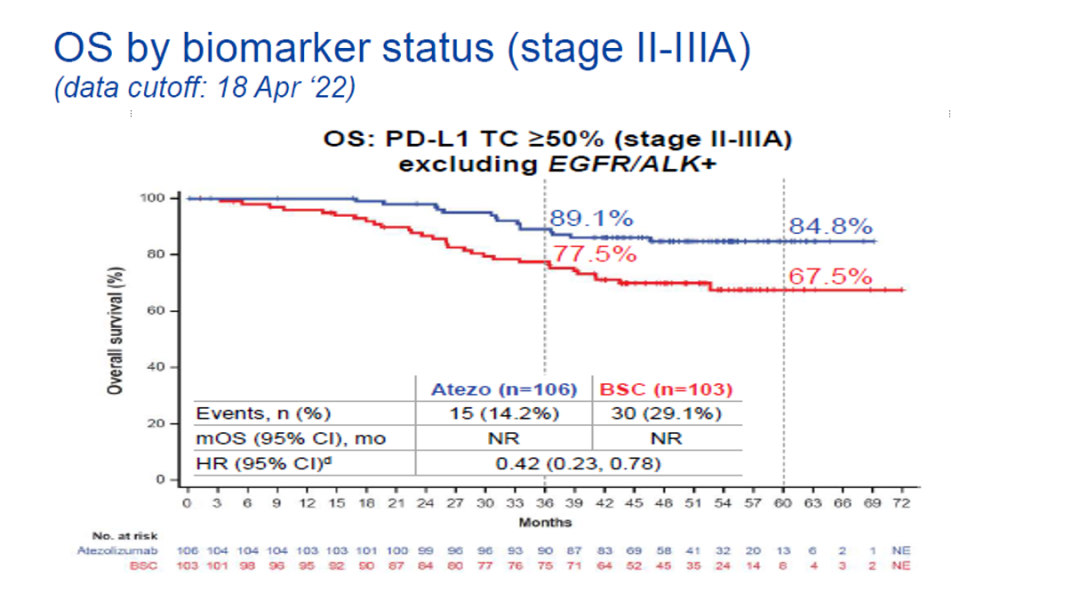
图2.PD-L1 TC≥50%的II-IIIA期患者OS数据
此外研究还进一步对PD-L1 TC≥1%的II-IIIA期NSCLC患者OS数据进行了亚组分析。结果显示,在不同疾病分期与淋巴结侵犯等各关键亚组中,阿替利珠单抗均可观察到明显的获益趋势,进一步验证了阿替利珠单抗作为NSCLC术后辅助治疗的疗效(图3)。
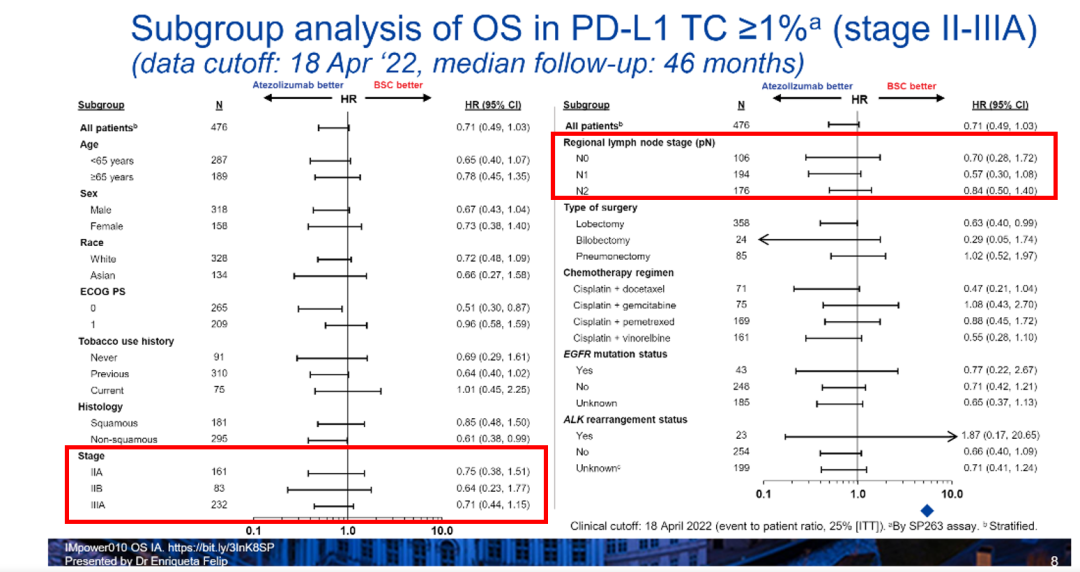
图3.PD-L1 TC≥1%的II-IIIA期患者亚组分析数据
周彩存教授表示,“既往的含铂双药辅助化疗,只能把患者的5年OS率提高5%[2],辅助靶向治疗也还没能看到OS获益,现在阿替利珠单抗辅助治疗能够提升10%的5年OS率,尤其是对于高表达的患者能够提高近20%,是非常了不起的成就。这些数据同样提示我们,对于PD-L1 TC≥1%的II-IIIA期患者应进行阿替利珠单抗辅助免疫治疗,尤其是对PD-L1 TC≥50%的患者。这会使早期可手术NSCLC患者的生存率再创新高,远超过单纯手术和手术+辅助化疗的水平,真正让患者有治愈的可能性。”
周彩存教授还表示,本次公布的IMpower010研究OS中期分析数据,成功地证明了DFS获益转化为远期的OS获益,进一步证实阿替利珠单抗辅助治疗是目前新的辅助治疗标准方案。
阿替利珠单抗辅助免疫治疗安全可靠,
为早期肺癌患者保驾护航
由于NSCLC术后辅助治疗的用药周期相对更长,例如IMpower010研究设计中,在患者完成手术及辅助化疗(1-4个周期)后,阿替利珠单抗用药时长为1年,治疗相关的安全性和患者耐受性问题,同样是外科、内科临床工作者和患者关切的问题。此前公布的安全性数据显示,阿替利珠单抗辅助治疗的安全性好,3-4级治疗相关不良事件(TRAEs)、治疗相关严重不良事件(SAEs)及不良事件导致的减量/停药发生率低,患者对治疗耐受良好。
周彩存教授表示,在本次WCLC公布的安全性数据则是首次主要DFS分析后额外随访13个月的结果,相关数据与此前报告的数据基本一致:研究未发现新的安全性信号,阿替利珠单抗辅助治疗组的3-4级TRAEs、SAEs和停药/减量发生率,并未因随访期延长至4年而明显改变(见表1)。
表1.IMpower010研究更新的安全性数据
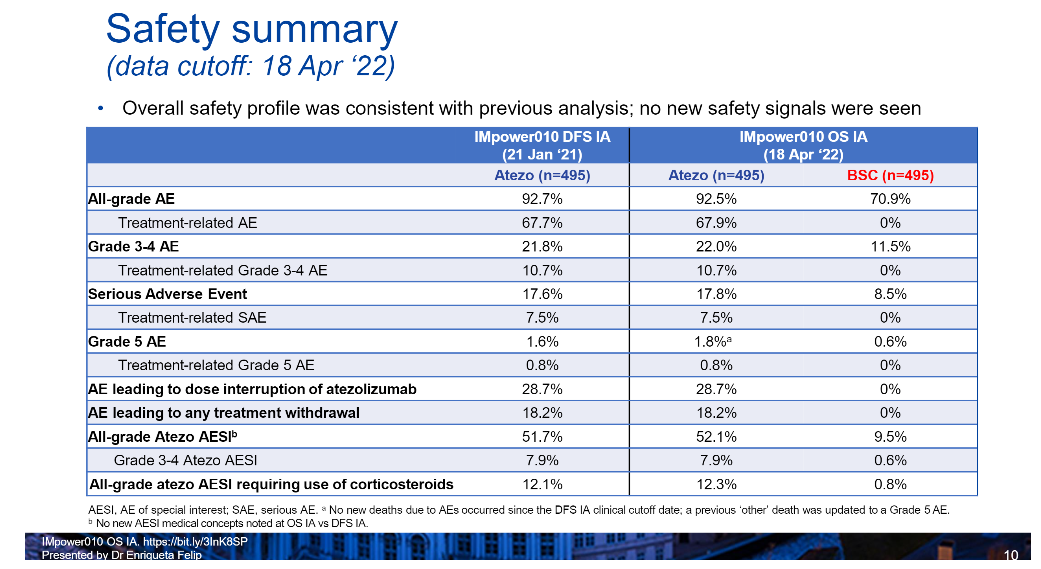
对此周彩存教授也指出,“不同的ICI毒性不尽相同,PD-L1抑制剂的安全性相比PD-1抑制剂本就更好,荟萃分析显示,阿替利珠单抗在ICI中具有最高的安全性[3],此外我们也从入组研究的患者当中观察到,3-4级TRAEs的发生率相当低,绝大多数患者都是可以耐受的。而且阿替利珠单抗已经在国内获批治疗小细胞肺癌(SCLC)、PD-L1高表达转移性NSCLC和转移性非鳞状NSCLC等多项适应症,进一步证实阿替利珠单抗的疗效和安全性。国内临床工作者已对阿替利珠单抗的应用有丰富经验,相信阿替利珠单抗辅助治疗的应用也会是安全、高效的。”
探索和优化生物标志物,
让辅助免疫治疗使用更精准
通过PD-L1表达水平、循环肿瘤DNA(ctDNA)等生物标志物,细化患者人群选择,实现更加精准化、个体化的治疗,是当前整个癌症治疗领域整体发展的大方向,因此IMpower010研究也开展了相关分析。
周彩存教授介绍,PD-L1表达水平是目前免疫治疗用于晚期NSCLC最重要的标志物,可指导治疗方案的选择、预测患者临床获益。IMpower 010研究进一步证实在早期NSCLC中PD-L1表达水平也是重要的生物标志物。IMpower 010研究在设计上使用了SP142、SP263两种PD-L1检测,其中SP263检测在国内使用相对更广泛。结合研究数据进行的分析显示,两项平台检测的PD-L1表达水平,均与辅助免疫治疗疗效有较好的相关性,起到了相互验证的作用[4]。本次WCLC公布的OS期中分析数据,也进一步支持了对PD-L1表达阳性(TC≥1%)的患者使用辅助免疫治疗。因此临床医生应加强对NSCLC患者PD-L1检测的重视,精准选择出能够从辅助免疫治疗中获益的优势人群,给患者带来更大获益。
而在其它生物标志物方面,周彩存教授认为从IMpower010研究的现有数据来看,EGFR/ALK两大驱动基因阳性的患者,暂不建议首选辅助免疫治疗,可考虑相应的辅助靶向治疗;而去年发表在ESMO-IO报告的分析还显示,患者术后检测ctDNA阳性是DFS的不良预后因素,但无论是否检测到ctDNA阳性,阿替利珠单抗辅助免疫治疗,对PD-L1 TC≥1%的II-IIIA期患者均有DFS获益(图4),提示ctDNA在不良预后因素的预测方面有重要的价值,因此不主张用ctDNA进行疗效预测。
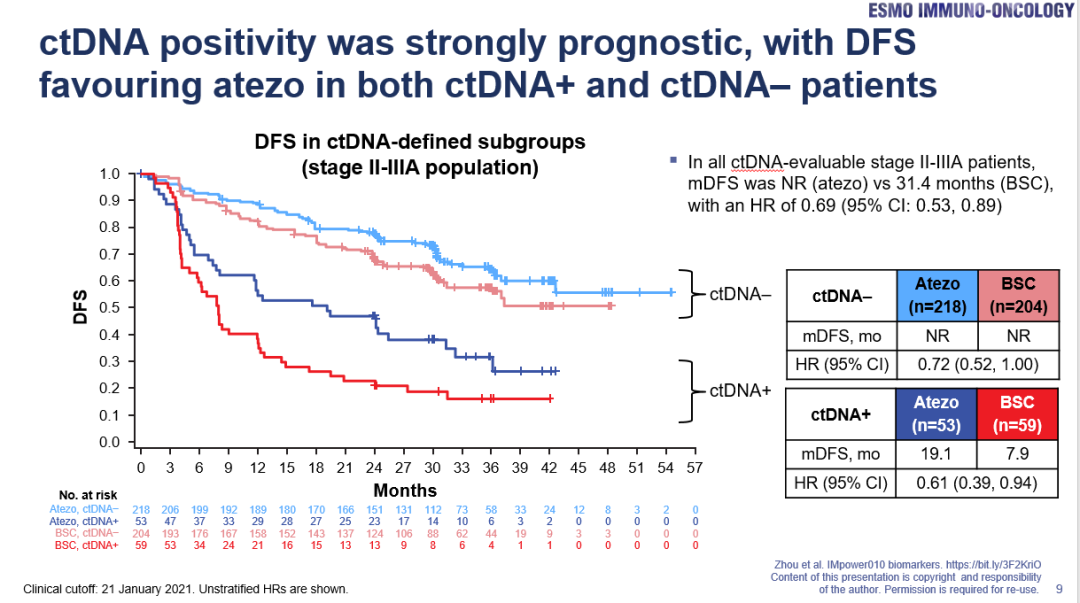
图4.无论患者术后ctDNA检测是否阳性,阿替利珠单抗辅助治疗均有DFS获益
本次WCLC更新的IMpower010研究OS期中分析结果,又是围手术期免疫治疗的一个里程碑,同时也为后续的临床探索提供了启示和指引。周彩存教授认为,“IMpower010研究证实了免疫单药辅助治疗的价值,开启了辅助免疫治疗新纪元,现在免疫+化疗的新辅助治疗也被确立了,但关于围手术期治疗仍然还有很多值得探索。例如围手术期最佳治疗模式的探索,目前已有像IMpower030把新辅助免疫和辅助免疫联合到一起的多项临床研究在开展之中,预计明年到后年就会相继公布结果。以及包括新辅助/辅助治疗的最佳周期,以及手术间隔后时长等问题都是值得探索的方向。”
另外,PD-1/L1抑制剂与其它免疫治疗药物,如已获批的CTLA-4抑制剂,针对TIGIT、NKG2A、CD73等靶点,正进行临床研究的免疫检查点抑制剂联合使用,同样是值得关注的重要方向,不过周彩存教授表示,早期NSCLC临床研究往往用时长、样本量大,因此免疫+免疫联合治疗的前景还有待进一步观察。
专家简介

周彩存 教授
同济大学附属上海肺科医院
中国临床肿瘤学会执行委员
中国医促会胸部肿瘤分会主任委员
国际肺癌研究学会董事会委员(IASLC BOD)
中国临床肿瘤学会非小细胞专委会主任委员
中国抗癌协会肺癌专业委员会常委
上海市抗癌协会副理事长
上海市抗癌协会肺癌分子靶向和免疫治疗专委会主任委员
中国抗癌协会肿瘤药物临床研究专业委员会副主任委员
中国医师协会肿瘤分会常委
上海市医师协会肿瘤分会副会长
上海市医学会肿瘤分会副主任委员
同济大学医学院肿瘤研究所所长
上海市领军人才
参考文献:
[1]Felip E,Altorki N,Zhou C,et al.Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB–IIIA non-small-cell lung cancer(IMpower010):A randomised,multicentre,open-label,phase 3 trial[J].The Lancet,2021,398(10308):1344-1357.
[2]Group N M C.Adjuvant chemotherapy,with or without postoperative radiotherapy,in operable non-small-cell lung cancer:two meta-analyses of individual patient data[J].The Lancet,2010,375(9722):1267-1277.
[3]Wang Y,Zhou S,Yang F,et al.Treatment-related adverse events of PD-1 and PD-L1 inhibitors in clinical trials:a systematic review and meta-analysis[J].JAMA Oncology,2019,5(7):1008-1019.
[4]Zhou C,Thakur M D,Srivastava M K,et al.2O IMpower010:Biomarkers of disease-free survival(DFS)in a phase III study of atezolizumab(atezo)vs best supportive care(BSC)after adjuvant chemotherapy in stage IB-IIIA NSCLC[J].Annals of Oncology,2021,32(S7):S1374.
来源:医学界
责编:郑华菊
校对:臧恒佳
热文推荐
| 留言与评论(共有 0 条评论) “” |