*仅供医学专业人士阅读参考
2022年WCLC放疗前沿进展速递!
在非小细胞肺癌(NSCLC)患者治疗中,放疗是重要的局部治疗手段,对于晚期NSCLC患者,全身治疗为主要的治疗方式,但是在临床实践过程中,单靠全身治疗依旧不能够彻底解决肿瘤的残留病灶,因此局部放疗依然不可或缺。近年来部分研究显示,免疫治疗与放疗存在协同作用,放疗可能增强免疫治疗的全身抗肿瘤反应,然而放疗与其他全身治疗手段联合使用是否能改善晚期NSCLC患者的预后仍有待更深入的探索。
2022年世界肺癌大会(WCLC )于8月6-9日在奥地利维也纳举行。针对放疗在NSCLC中的应用,本文整理了相关的三项研究与读者一同分享!
肺癌骨转移姑息性放疗的反应-来自印度的前瞻性纵向研究结果
(摘要号:MA09.03)
来自印度的一项前瞻性纵向研究报告了接受放疗的肺癌无症状性骨转移(BM)患者的结果,并且观察疼痛反应的模式和持续性以及生活质量的变化[1]。
从2020年6月至2021年10月,该前瞻性研究纳入了经组织学证实的肺癌伴放射学证实的BM患者。大多数患者使用常规的放疗对BM带来的疼痛进行姑息治疗,主要终点为2周和4周时的疼痛反应,次要终点为3个月和6个月时的疼痛反应。研究中采用数字疼痛量表来对患者进行疼痛评分记录,并且将阿片类镇痛药剂量转换为口服吗啡等效剂量(OMED),疼痛反应根据最新的国际BM共识反应标准进行评估,从基线起,直至患者出现疼痛进展或死亡,用以测量疼痛无进展生存(PFS)。此外,使用欧洲癌症治疗研究组织(EORTC)生命质量测定量表 QLQ-C30和BM22记录患者的生活质量。
该研究连续纳入了125例患者,大多数为NSCLC(95%)、男性(67%)和非吸烟者(77%)。大多数存在溶解性病变(83%)且在中轴骨骼中(77%)。47%的患者发现了驱动基因阳性并且接受了TKIs治疗,70%的患者接受单后野常规放疗,最常用的剂量为单次8Gy。在基线检查中,平均疼痛评分为5.5(SD±2.46),平均OMED为17.5mg/天(SD±18.8)。
研究结果显示,放疗后,2周(n=86)、4周(n=85)、12周(n=67)和24周(n=47)的完全缓解(CR)率分别为9%、19%、36%和38%,部分缓解(PR)率分别为37%、48%、42%和32%,客观缓解率(ORR=CR+PR)分别为37%、48%、78%和70%;不确定反应(IR)率分别为45%、27%、21%和25%,而疼痛进展(PP)率分别为8%、6%、1.5%和4%。在3个月和6个月时阿片类药物的需求显著减少,平均OMED分别为11(±15.2)和6(±11.6)mg/天。
在突变阳性队列中,疼痛反应的中位持续时间显著较高(7.8 vs 4个月,p=0.003),再放疗率为13.6%,中位时间为4.4周,疼痛PFS率在3个月和6个月时分别为82%和69%。放疗耐受性良好,无II级或更严重的急性或晚期毒性。在3个月时,患者的生活质量包括疼痛、情绪功能、疲劳、失眠和整体健康等方面,评分得到了显著改善。此外,BM22评估的症状和功能方面也显示出60%的患者的平均绝对得到有统计学意义的显著改善。
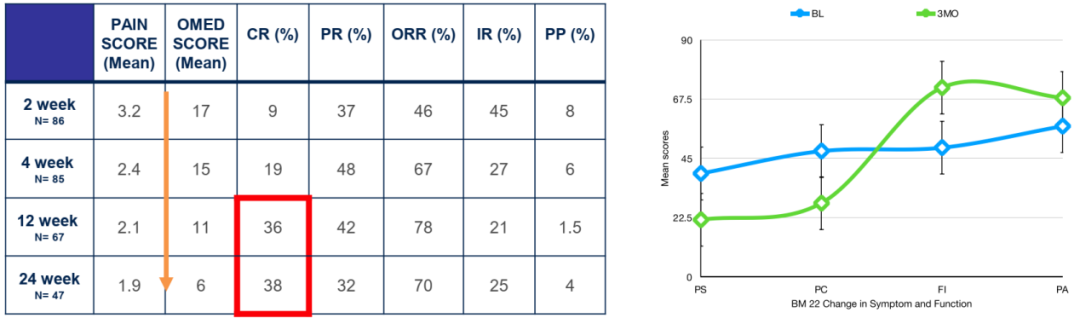
图1. 主要研究结果
(BL:基线;3MO:3个月;PS:疼痛位点;PC:疼痛性质;FI:功能障碍;PA:社会心理)
这项前瞻性研究显示,针对肺癌无症状性BM患者,常规放疗可获得优异且持久的总体缓解率,并显著改善患者的生活质量。但结果也提示,在存在基因突变阳性的患者中,应确定哪些患者需要再次接受放疗,并且可能需要更适形的高剂量放疗。
PD-1抑制剂和化疗联合或不联合放疗一线治疗晚期NSCLC[2]
(摘要号:MA09.04)
近年来,免疫治疗已成为晚期NSCLC的标准一线治疗方案。部分研究表明,免疫治疗和放疗在局部和远处肿瘤控制方面具有协同作用。但一线免疫+化疗+放疗治疗晚期NSCLC的资料目前仍然较少。该研究回顾性分析了单中心接受PD-1抑制剂免疫治疗+化疗的晚期NSCLC患者,并且根据是否接受过放疗,将患者分为两组,观察一线免疫+化疗联合放疗(ICRT组)和免疫+化疗组(ICT)的疗效和安全性。
该研究共纳入135例患者,其中65例接受PD-1抑制剂联合化疗和放疗,而其他70例患者仅接受免疫+化疗。放疗和PD-1抑制剂免疫治疗之间的中位间隔时间为5天(范围为0-96天)。
结果显示,与ICT组相比,ICRT组患者的中位PFS(16.5 vs 10.4个月,P=0.043)和中位OS(未达到 vs 21.0个月,P=0.030)显著延长。
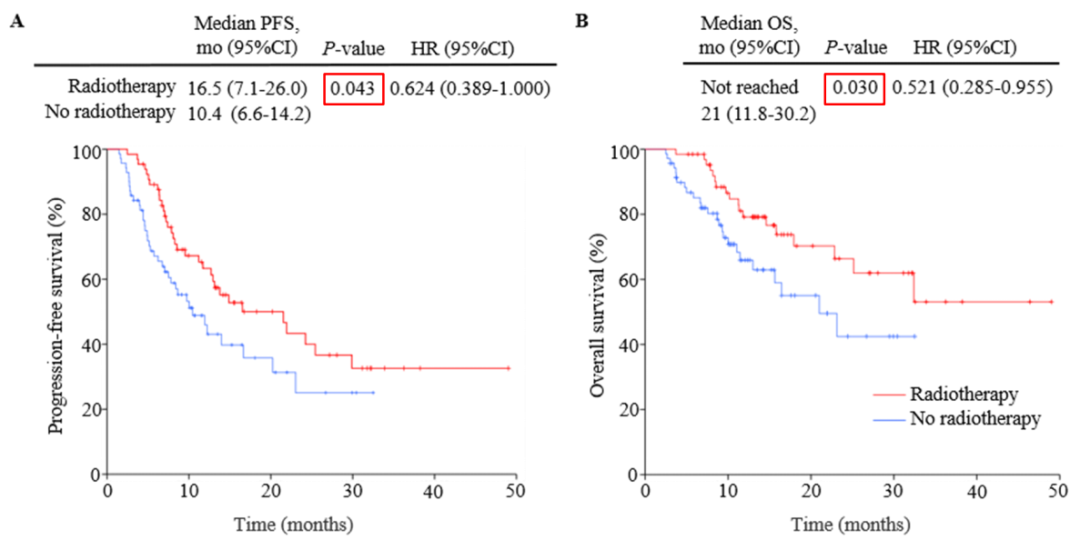
图2. PFS(A)和OS(B)的Kaplan-Meier分析
单变量Cox回归分析发现,增加放疗是PFS(HR=0.617,95%CI:0.385-0.989,P=0.045)和OS(HR=0.512,95%CI:0.277-0.947,P=0.033)的唯一预后因素。
安全性方面,患者的耐受性良好,ICRT组和ICT组之间不良事件的总发生率相似。ICRT组有一例患者因严重免疫相关肺炎而停止免疫治疗,3-4级放疗相关不良事件的发生率为3.1%。
该研究结果提示,在一线PD-1抑制剂免疫治疗和化疗的基础上加放疗可改善晚期NSCLC患者的预后,且毒性可耐受。后续可进行更多的前瞻性研究,探索免疫+化疗和放疗在NSCLC一线治疗中的应用。
放疗改善III期和IV期非小细胞肺癌患者的免疫治疗疗效[3]
(摘要号:MA09.08)
放疗可能增强免疫治疗的全身抗肿瘤反应。研究者们进行了一项回顾性分析,以探索放疗是否能改善III期或IV期非小细胞肺癌患者的免疫治疗结果。这项在恩泽医学中心进行的研究于2018年12月1日至2021年12月31日期间纳入了259例经组织病理学证实的NSCLC患者。这些III期或IV期NSCLC患者适宜接受信迪利单抗免疫治疗,其中部分患者在特定的时间接受放疗。放疗包括常规放疗(64.8Gy/30F和54Gy/25F)和立体定向全身放疗SBRT:50Gy/5F和60Gy/8F)。该研究的终点为PFS率和OS率。
纳入研究的259例患者中有140例接受免疫治疗,119例接受免疫加放疗。治疗组之间的基线变量无差异,包括性别和年龄、吸烟状况、TNM分期和转移数量以及ECOG分级和组织学。
研究结果显示,总体人群的PFS均为6个月(95%CI:5.03-6.97),其中接受单独免疫治疗与免疫加放疗的患者的PFS分别为5个月(95%CI:4.38-5.62)和9个月(95%CI:5.95-12.05;p<0.001)。总体人群的中位OS为20个月(95%CI:15.27-24.73),其中接受单独免疫治疗和免疫治疗加放疗的患者的OS分别为16个月(95%CI:12.59-19.42)和30个月(95%CI:20.75-39.25;p=0.027)。
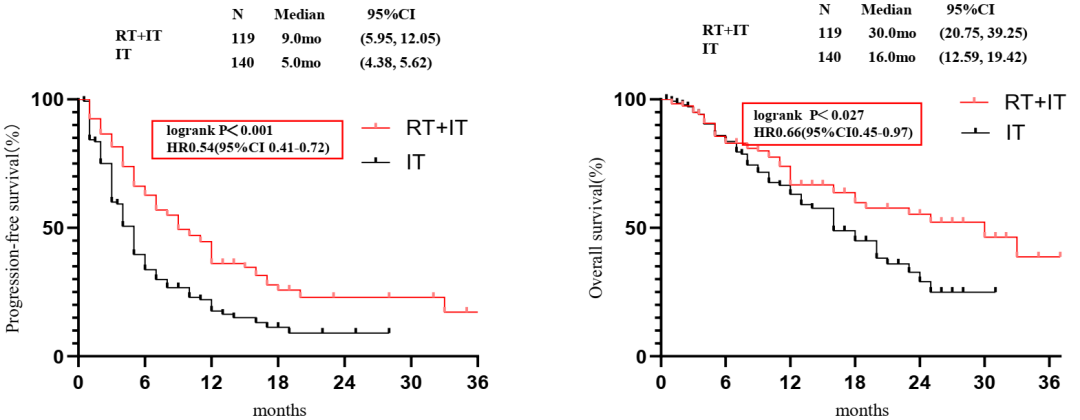
图3.总人群PFS和OS结果
单变量分析显示,ECOG=0(P=0.03)、男性(P=0.002)、放疗(P<0.001)与更好的PFS率相关。多变量分析显示,放疗(HR=1.89,95%CI:1.41-2.54,P<0.001)和ECOG=0(HR=1.55,95%CI:1.16-2.07,P=0.003)是独立的预后因素,PFS率显著提高。
此外,单变量分析显示,ECOG=0(P=0.002)、女性(P=0.036)、III期(P=0.002)、鳞状细胞癌(P=0.025)和无转移(P=0.01)与OS率显著提高相关。多变量分析显示,无转移(HR=2.42,95%CI:1.29-4.54,P=0.02)是一个独立的预后因素,OS率显著提高;放疗(HR=1.42;95%CI:0.95-2.14,P=0.09)也与较高的OS率存在相关性。
表1. PFS和OS的单变量和多变量cox分析结果
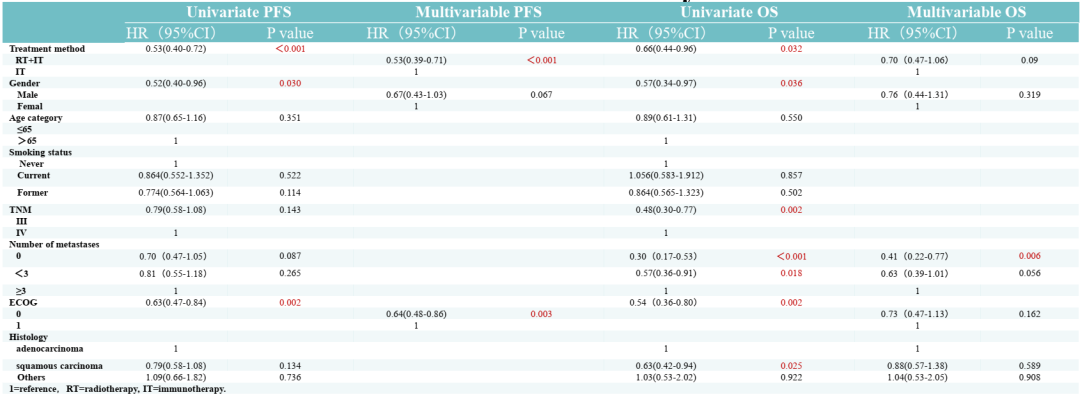
该研究提示,在免疫治疗中增加放疗与NSCLC患者改善预后显著相关。不过未来仍需要开展前瞻性研究来进一步证实免疫联合放疗一线治疗的疗效与安全性。
本材料由阿斯利康提供支持,仅供医疗专业人士参考
审批编号:CN-101262 过期日期:2023-8-24
参考文献:
[1]A. Agrawal, A. Tibdewal, T. Tahmeed, N. Mummudi, J.P. Agarwal,et al.Response of Palliative Radiotherapy in Bone Metastases of Lung Cancer - Results of Prospective Longitudnal Study from India.2022WCLC. MA09.03.
[2]P. Ding, Y. Huang, F. Tong, L. Chen, L. Wen, R. Zhang, S. Cheng, X. Dong,et al.First-line PD-1 Inhibitors and Chemotherapy Combined with or without Radiotherapy in Advanced Non-small-cell Lung Cancer.2022WCLC. MA09.04.
[3]S. Li, K. Chen, M. Chen, Y. Meng, H. Yang,et al.Radiotherapy Improves Outcomes to Immunotherapy in Patients with Stage III and IV NSCLC.2022WCLC. MA09.08.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |