高中化学同步讲座
主讲:宗伟老师
陕西省首届省级高中化学骨干教师和教学能手,全国化学竞赛优秀辅导员,中学化学高级教师,曾任教于西安市第一中学、西安电子科技大学附中、西工大文化补习学校和西安黄冈文化补习学校

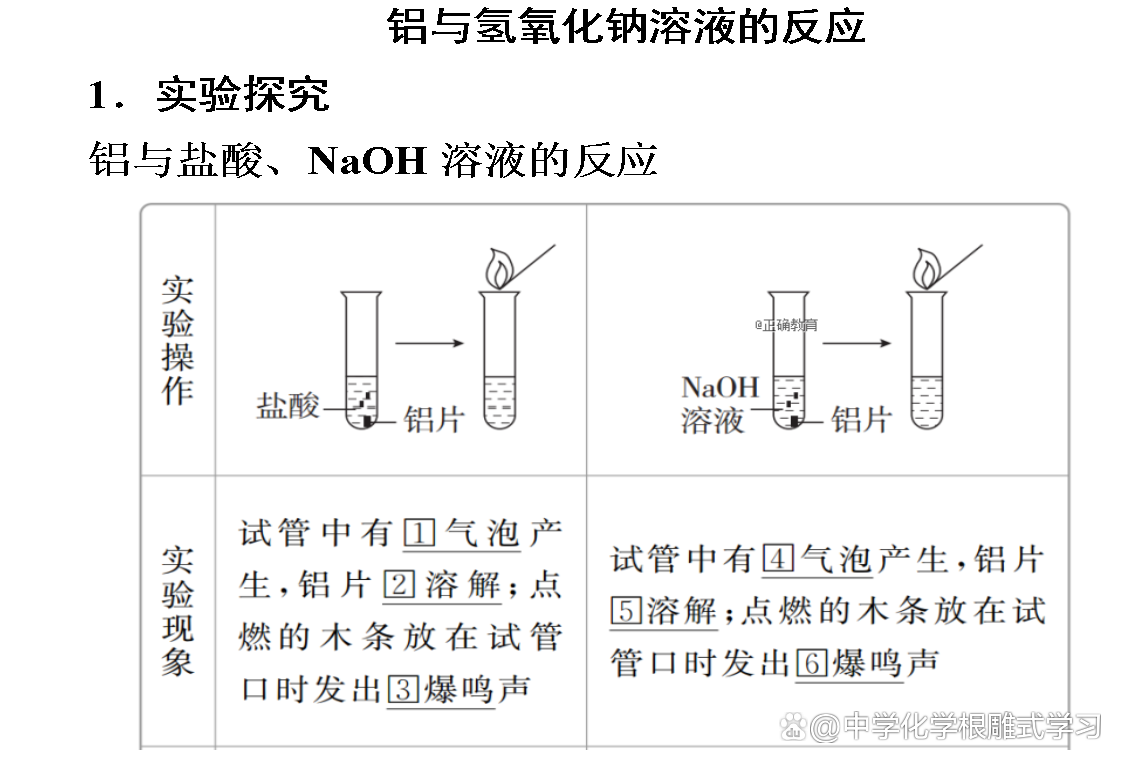

2.实验结论
铝既能与盐酸反应又能与NaOH溶液反应。
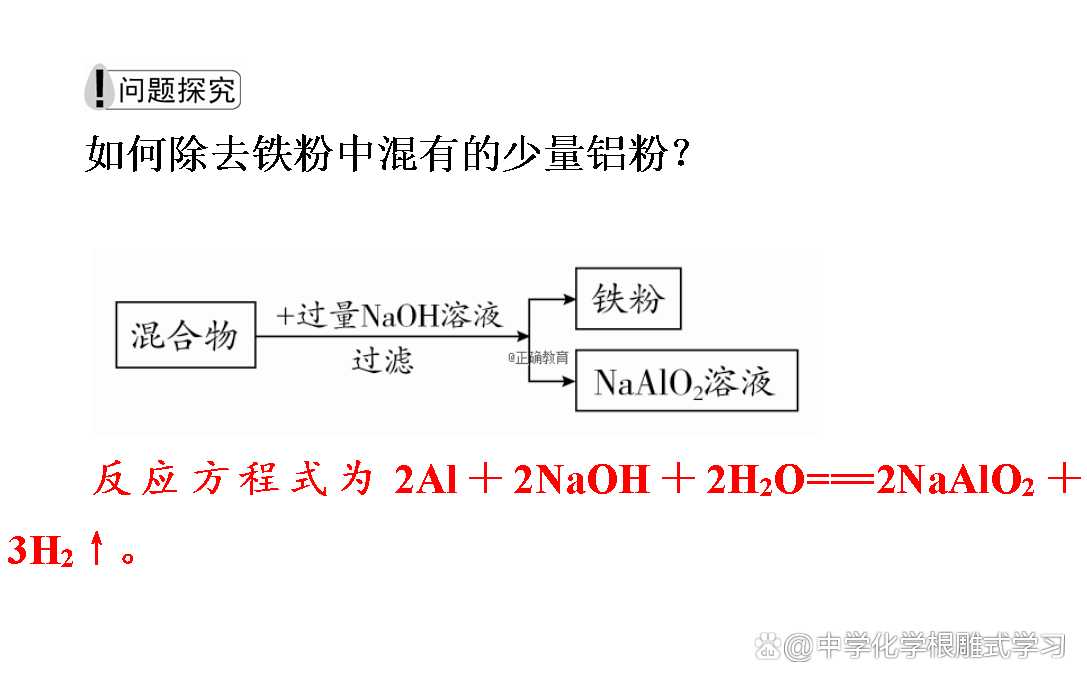

2.“量”的关系
(1)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗HCl和NaOH的物质的量之比为3∶1。
(2)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶1。
(3)足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶3。
1.等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶7,则甲、乙两烧杯中的反应情况可能分别是( B )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
2.用铝箔包裹着2.3 g金属钠,用针扎若干小孔,然后投入到足量水中,理论上可以收集到氢气的物质的量为( C )
A.0.05 mol
B.0.2 mol
C.大于0.05 mol小于或等于0.2 mol
D.无法判断
铝跟弱碱NH3·H2O溶液不反应,跟NaOH、KOH等强碱溶液反应产生H2。



| 留言与评论(共有 0 条评论) “” |