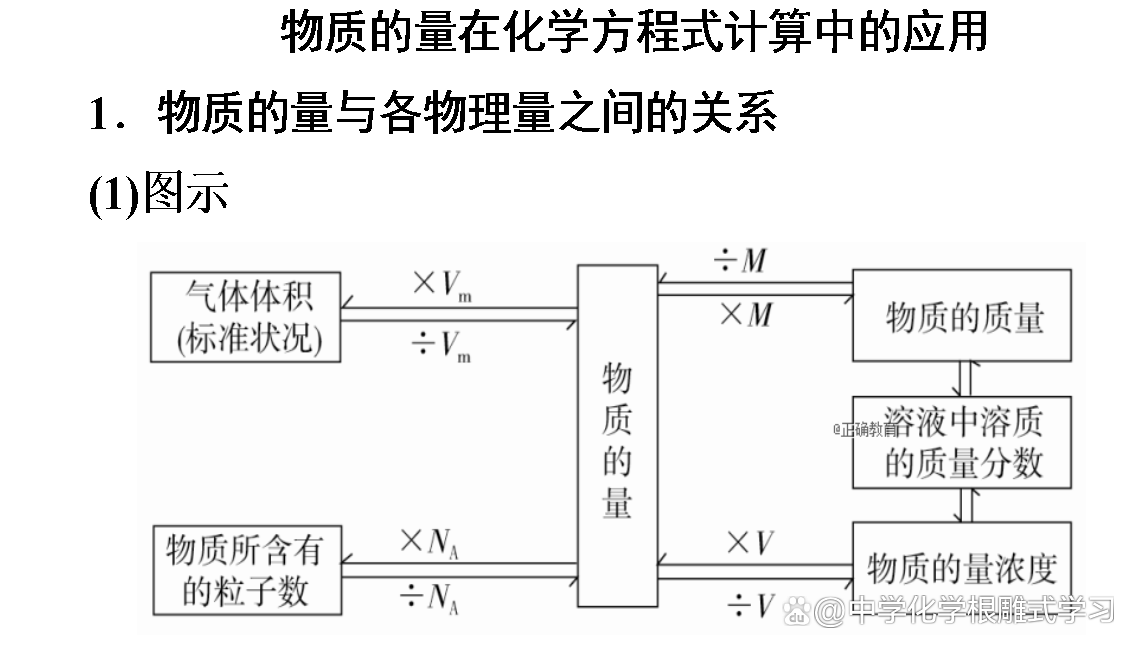
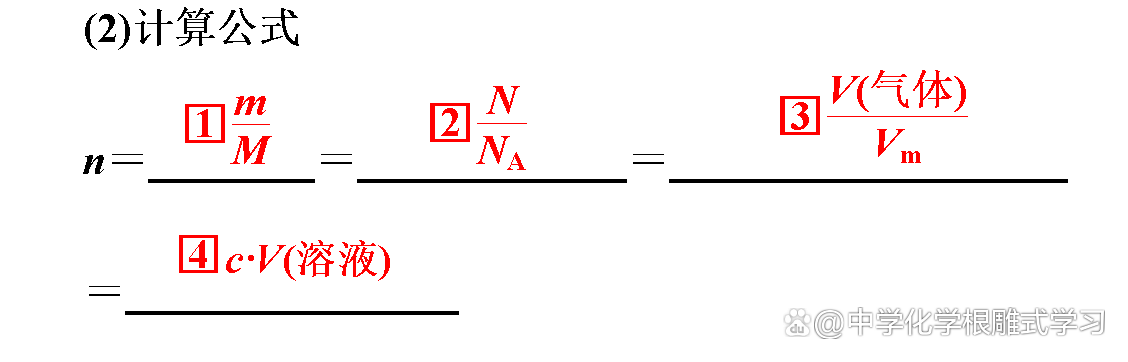

“化学反应前后质量是守恒的,那么物质的量也肯定守恒。”这种说法对吗?
不对。化学方程式中各物质的物质的量之比等于各物质的化学计量数之比,所以化学反应前后,物质的量可能增大、减小或不变。
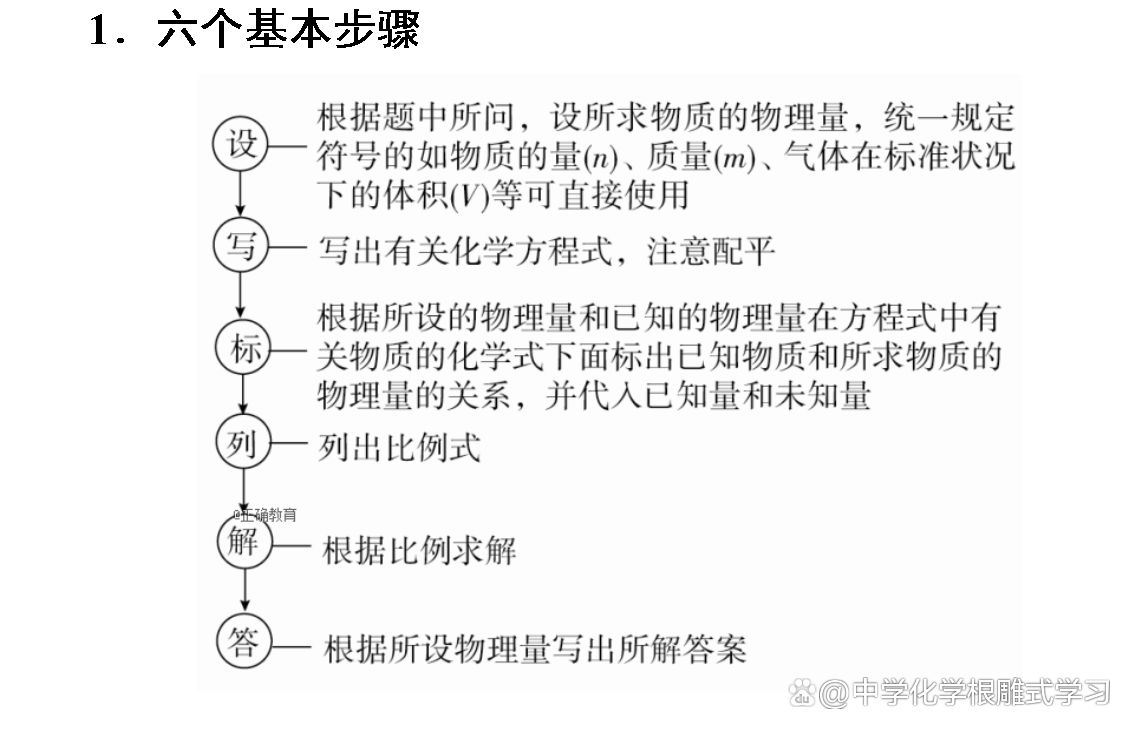
2.两种计算类型
(1)基本计算
已知一种反应物(或生成物)的量求解其他物质的有关量,此时,只要按照化学方程式的量的关系,列出已知物质和待求物质的比例式计算便可。
(2)过量计算
给出了两种反应物的量,求解某产物的量。
方法:按照化学方程式的量的关系判断哪一种物质过量,然后根据量不足的物质进行求解。
(3)混合物反应的计算
设出混合物中各物质的物质的量为x、y、z,按照化学方程式的量的关系,并用x、y、z表示,列出方程组解答。
把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量。
(2)该混合物中铝、铁的物质的量。

1.等质量的两份铝分别与足量稀硫酸和足量NaOH溶液反应,若消耗的两溶液的体积相等,则两溶液的物质的量浓度之比为( A )
A.3∶2 B.2∶3 C.1∶1 D.1∶2

2.向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和溶液的物质的量浓度。
(3)生成的H2在标准状况下的体积。

把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO4(2-)的物质的量浓度之比为( )
A.1∶4 B.2∶7
C.1∶2 D.3∶8

判断反应物过量的方法
(1)假设法
假设一种反应物完全反应,而另一种反应物的量未知,把所求得的结果与实际量相比较,若小于实际值,则说明假设成立,反之则说明假设不成立,即该反应物过量。

归纳总结
1.铝是既能与酸反应又能与碱溶液反应生成H2的金属。
2.在反应2Al+2NaOH+2H2O===2NaAlO2+3H2↑中,铝作还原剂,水作氧化剂。
3.化学方程式中各物质的化学计量数之比等于各物质的物质的量之比。
4.在根据化学方程式计算时,物理量选用的原则是:上下一致,左右相当。



| 留言与评论(共有 0 条评论) “” |