仅供医学专业人士阅读参考

2022 WCLC精彩解读
2022年国际肺癌研究协会(IASLC)世界肺癌大会(WCLC)于8月6日-9日以线下+线上的形式举办。WCLC是肺癌领域的年度盛典,众多重磅研究结果公布并推动临床实践更新,吸引着全球专家学者的目光。
随着检测技术的发展和各式新药的涌现,临床医生不再在治疗中“一条道走到黑”,而是“边治疗边检测边调整”,为患者选择最佳方案,真正践行精准治疗。本次大会又为我们带来哪些新的“路标”呢?一起来看!
精彩提要:
1.如何突破免疫耐药难题,选择NSCLC最佳后线方案?生物标志物来指路!
2.新辅助化免治疗结果早预测?基线ctDNA水平与NADIM II试验的OS和PFS显著相关!
3.用皮尺+握力计就能预测肺癌治疗结果?营养干预需重视!

扫描上方二维码,获取WCLC前沿资讯与专家观点
HUDSON:An Open-Label,Multi-Drug,Biomarker-Directed Phase 2 Study in NSCLC Patients Who Progressed on Anti-PD-(L)1 Therapy
▌ HUDSON:一项关于PD-(L)1单抗治疗进展NSCLC患者的开放标签、多药物、生物标志物指导的II期研究
(摘要号:OA15.05)
HUDSON是一项在既往接受了含铂双药化疗和抗PD-(L)1免疫治疗(单药或联合),且在既往抗PD-(L)1治疗后出现疾病进展的晚期非小细胞肺癌(NSCLC)患者中开展的多臂、伞式研究。该研究评估了通过分子改变定制的多种治疗组合的疗效、安全性和耐受性,旨在克服对PD-(L)1抑制剂的耐药性。本次大会公布了初始联合方案的成熟疗效和安全性结果,包括度伐利尤单抗联合奥拉帕利(PARP抑制剂;模块1)、danvatirsen(STAT3抑制剂;模块2)、ceralasertib(ATR抑制剂;模块3)以及oleclumab(抗CD73抗体;模块5)。
根据肿瘤分子特征,患者被纳入生物标志物匹配(A组)或生物标志物非匹配(B组)队列。B组以既往抗PD-(L)1治疗的原发性或获得性耐药进一步细分,分别定义为开始治疗≤24周或开始治疗后>24周出现疾病进展。以总缓解率(ORR;主要终点)、无进展生存期(PFS)和总生存期(OS)为依据决定是否将每个初始队列样本量从20名扩大到40名患者。持续监测安全性。

试验设计
在2018年1月26日至2021 4月14日期间,共255名患者被纳入研究,并使用度伐利尤单抗联合奥拉帕利(n=87)、danvatirsen(n=45)、ceralasertib(n=66;A组队列正在累积,本次报告为n=21)或oleclumab(n=57)进行治疗。各治疗组的基线人口统计学和疾病特征总体平衡;分别有41.4%、44.4%、50.0%和43.9%的患者既往接受过≥3种治疗方案,19.5%、13.3%、24.2%和21.1%的患者接受过≥2种含铂疗法。
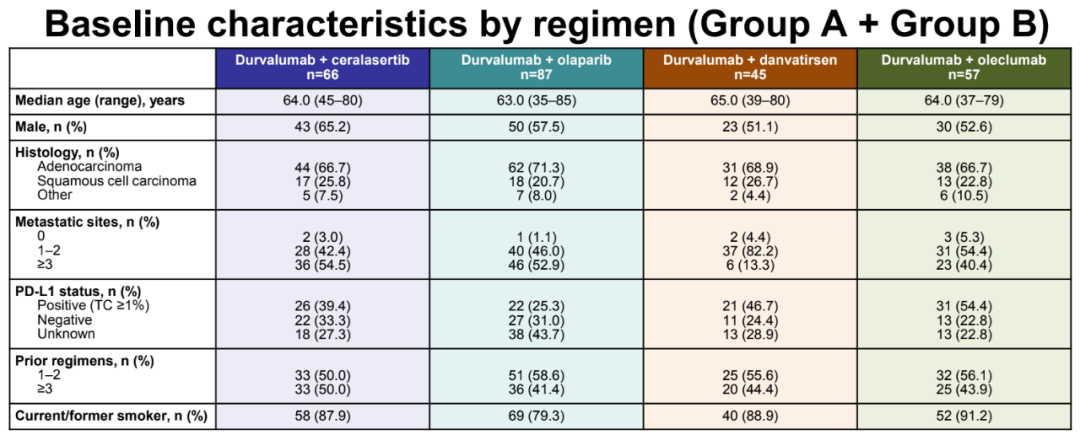
患者基线数据
在迄今为止评估的方案中,度伐利尤单抗联合ceralasertib方案的ORR(16.7%vs 0-4.8%)和12周/24周疾病控制率(12周:60.6%vs 26.7%-36.8%;24周:42.4% vs 13.3%-17.2%)在数值上最高,中位PFS(6.0个月,80%CI:4.6-7.5;其他方案:1.8-2.9)和OS(15.9个月,80%CI:14.1-20.3;其他方案:7.9-11.0)在数值上也最长;在这个模块中,生物标志物匹配队列的疗效也最佳。
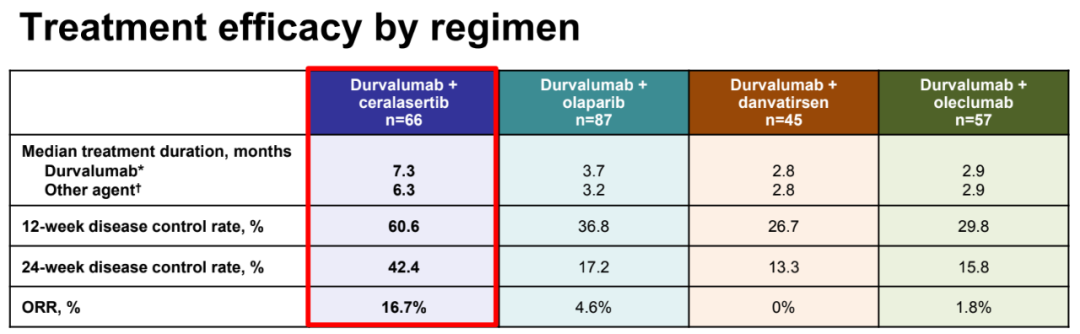
各治疗队列的疗效数据
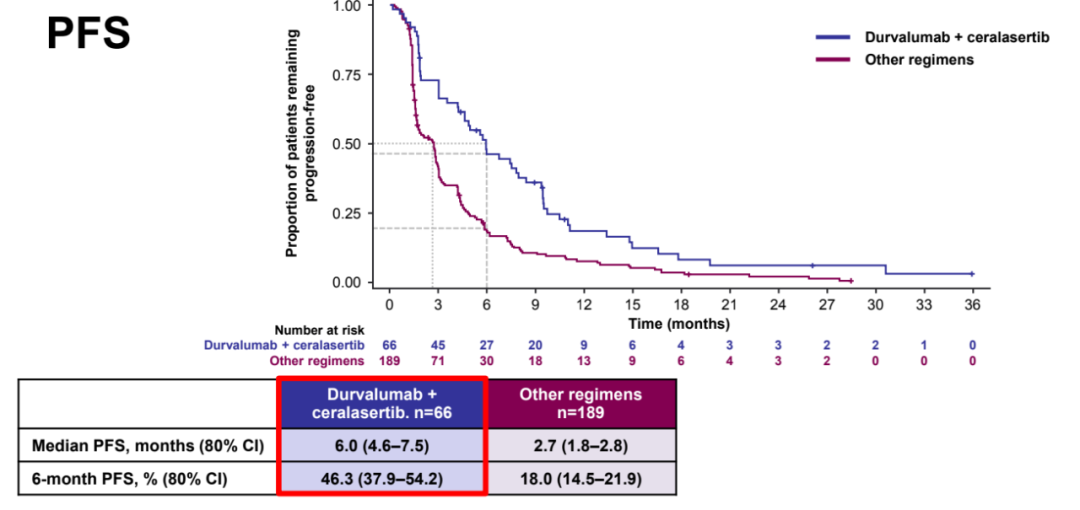
PFS数据

OS数据
中位OS在每个队列中都是显著的:在生物标志物匹配队列中为22.8个月(80%CI:12.6–29.9),原发性和获得性耐药队列分别为11.8(80%CI:6.6-18.8)和19.1(80%CI:14.1-20.3)个月。
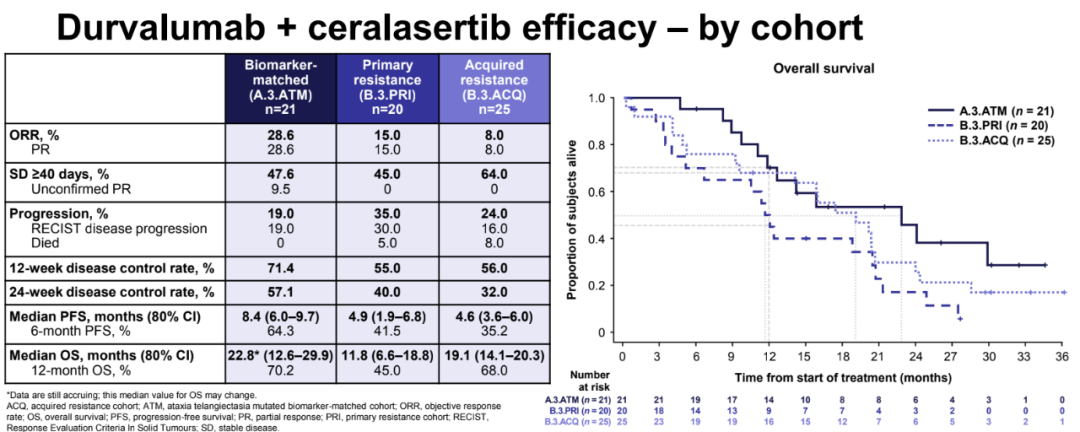
根据耐药状态与生物标志物匹配的各治疗队列疗效数据
大多数患者报告了与治疗相关不良事件(TRAE);与其他方案相比,度伐利尤单抗联合ceralasertib或Olcelumab的≥3级TRAE和因TRAE引起的停药率在数值上更低。最常见的TRAE是恶心(各治疗组发生率分别42.5%、2.2%、51.5%和7.0%),贫血(25.3%、8.9%、21.2%、3.5%)、疲劳(20.7%、13.3%、16.7%、14.0%)、食欲下降(9.2%、4.4%、22.7%、7.0%)、腹泻(12.6%、11.1%、15.2%、12.3%)和呕吐(20.6%、4%、28.8%)。

各治疗队列的安全性数据
结果表明,在抗PD-1/PD-L1免疫治疗和≥1个含铂双药方案失败的晚期/转移性NSCLC患者中,度伐利尤单抗联合ceralasertib显示出良好的疗效信号,且具有可耐受的安全性。
Pre-treatment ctDNA Levels Significantly Predicts of OS and PFS in NADIM II Trial
▌ 治疗前ctDNA水平显著预测NADIM II试验的OS和PFS结果
(摘要号:MA06.03)
纳武利尤单抗联合化疗新辅助治疗早期非小细胞肺癌(NSCLC)于2022年3月获得FDA批准。预测因素能区分疾病进展或死亡风险高或低的患者,以用于调整后续治疗。但目前尚无生物标志物可用于识别或筛选能从免疫治疗联合化疗中长期获益的人群。研究者在今年大会上公布了ctDNA水平与总生存(OS)和无进展生存(PFS)的相关性。
NADIM II是一项开放标签、随机、两臂、II期、多中心临床试验。ECOG PS 0-1,无已知EGFR/ALK改变的可切除IIIA(根据AJCC第7版)的NSCLC患者被随机分配为两组,联合治疗组接受新辅助纳武利尤单抗(360mg)+紫杉醇(200mg/m2)+卡铂(AUC 5),单独化疗组接受紫杉醇(200mg/m2)+卡铂(AUC 5)治疗,21天±3天为1周期,共3周期,序贯手术治疗。经病理学评估证实为R0切除的患者在术后第3至8周(+7天)内开始接受纳武利尤单抗辅助治疗(480 mg Q4W),为期6个月。使用TruSight Oncology ctDNA下一代测序(NGS)分析来自预处理血浆样品的循环肿瘤DNA(ctDNA)。

试验设计
中位随访时间为21.2(15.1-25.6)个月。在54份治疗前血浆样本中,有52份(91.4%)检测到基线ctDNA,且与肿瘤大小(最大直径≥70mm)显著相关(P=0.006)。治疗前ctDNA水平与PFS和OS显著相关,且与使用阈值无关。使用<5%突变等位基因频率(MAF)阈值,在基线时,与高ctDNA水平患者相比,低ctDNA水=平的患者的PFS和OS显著改善(对于PFS和OSS,分别为HR=0.19;95%CI:0.07-0.52;P=0.013和HR=0.13;95%CI:0.04-0.45;P=0.001)。

ctDNA水平与肿瘤大小、PFS以及OS的关系
研究结果表明,基线ctDNA水平可明确识别出高进展和死亡风险的患者,并可用于指导相应的后续治疗。
Do in Screening-Calf Circumference and Muscle Strength is Predictive
of Outcomes in Lung Cancer Treatment
▌ 在筛查中小腿围和肌肉力量可作为肺癌治疗结果的预测因素吗?
(摘要号:OA08.03)
肌肉质量低在肺癌患者中非常常见,会使治疗毒性发生率更高,身体功能、生活质量和死亡率更差。肌肉质量(MM)的评估方式,如计算机断层扫描,价格昂贵,可及性差,且不利于临床实践。本研究旨在探索在诊断时使用简单、低成本的测量方法[如小腿周长(CC)和握力(HGS)]测量MM,能否预测肺癌患者的癌症相关预后。
本研究为前瞻性、观察性临床研究,数据收集于2019年1月至12月的第一次营养会诊,包括患者主观总体评估(PG-SGA)的营养风险筛查、身高、体重、体重减轻(WL)、CC,以及手持握力计测量的HGS。CC采用的临界值经年龄调整。通过Kaplan-Meier分析生成生存曲线,以评估低MM合并低握力与3年死亡率之间的相关性。
本研究共入组50名肺癌患者,其中62%为女性,94%为老年人,88%为非小细胞肺癌,88%被诊断为III和IV期疾病,64%为吸烟者。62%的患者出现WL,36%的患者WL大于体重的5%(恶病质的一种衡量标准)。
在评估本次研究对象的CC(一种易用的MM指标,现于成人人群中也有临界值)时,44%的患者值低于临界值,表明MM低。在握力评估中,34%的患者肌肉力量低下。在OS评估中,MM低和肌肉力量低下的患者显著低于参数高于定义临界点的患者(349天vs 1247天;对数秩p<0.000;Breslow p<0.000;Tarone-Ware p<0.000)。尽管样本量有限,但本次结果发现可通过营养和多模式干预逆转的显著差异。
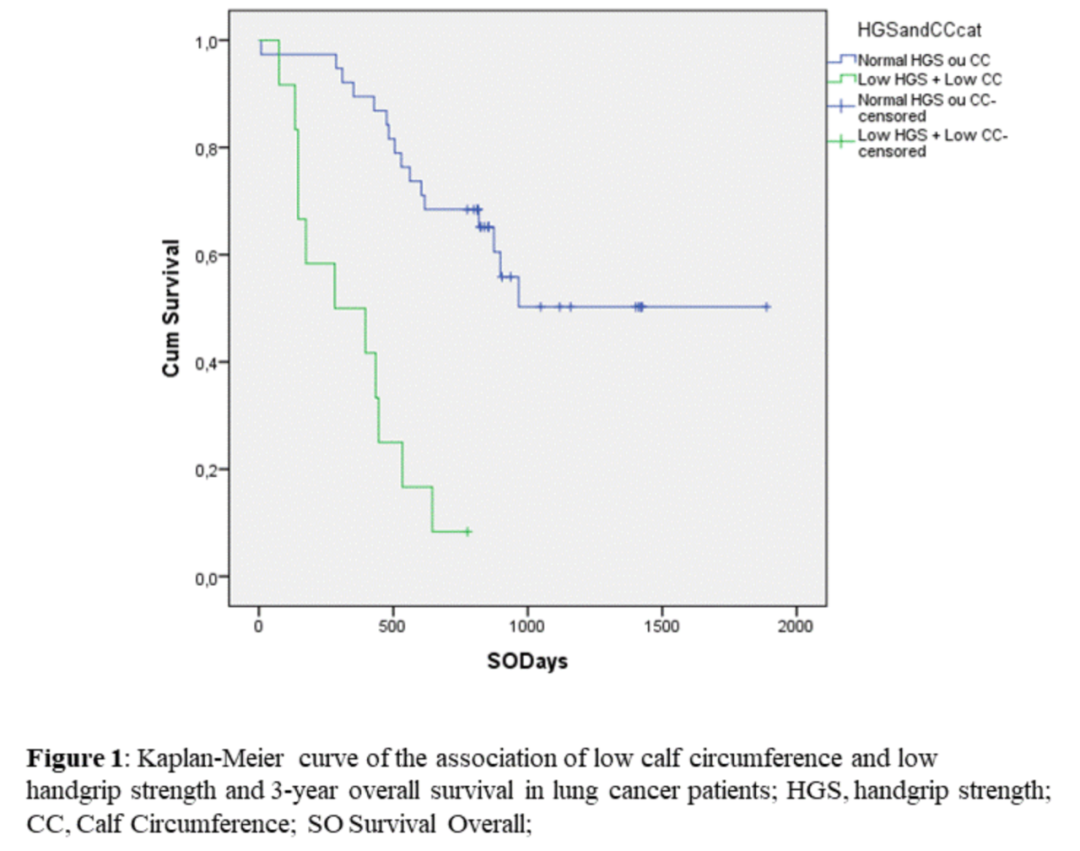
肺癌患者低小腿围、低握力与3年总生存期相关性的Kaplan-Meier曲线
使用一种普通、简便和可及的测量方法,如WC联合HGS,测量出的低MM是肺癌治疗中阴性结果的预测因子,应引起重视。只要及早发现,营养和多模式干预可以逆转低MM,从而改善这些患者的预后。
专家点评
免疫检查点抑制剂(ICIs)在肺癌治疗中取得了巨大成功,而对其生物标志物的探索也从未停止,尤其是对于ICIs耐药以及免疫联合治疗的患者,迄今仍缺乏理想的标志物指导临床实践。上述第1项研究发现,对于ICIs耐药的患者,通过多个标志物的平行检测和方案分配,发现了在ATM突变的患者中采用度伐利尤单抗联合ATR抑制剂ceralasertib治疗,取得了很好了疗效和安全性。而第2项研究是基于肺癌新辅助治疗的NADIM II试验的标志物研究,结果发现基线ctDNA水平可预测患者对联合治疗的生存获益,这有助于鉴定新辅助联合治疗的获益人群,进一步实现精准免疫治疗。
此外,肺癌预后因素的研究也是临床医生关注的重点。本文第3项研究采用了一种简便易行的方法,通过评估肌肉质量来预测中晚期肺癌的治疗效果,并取得了较好的预测效力。这提示临床中有必要通过提高患者营养状态,进一步改善肺癌的预后。
专家简介

胡志皇
医学博士、副主任医师,复旦大学附属肿瘤医院
胸部肿瘤内科科主任助理
美国临床肿瘤学会(ASCO)会员
中国抗癌协会临床肿瘤化疗专委会委员
中国医药教育协会肺部肿瘤专委会COE秘书
中国临床肿瘤学会(CSCO)会员
上海市抗癌协会会员
上海市抗癌协会CRPC青委会常委
从事肺癌、食管癌等胸部肿瘤的内科治疗与研究,在肿瘤新靶点鉴定、分子标志物研究、肿瘤姑息治疗等领域有较深入研究,曾发表SCI论文十余篇,主持科研基金2项。
参考文献:
[1]Mark M.Awad,et al.OA15.05-HUDSON:An Open-Label,Multi-Drug,Biomarker-Directed Phase 2 Study in NSCLC Patients Who Progressed on Anti-PD-(L)1 Therapy.2022WCLC.OA15.05.
[2]Roberto Serna,et al.MA06.03-Pre-treatment ctDNA Levels Significantly Predicts of OS and PFS in NADIM II Trial.2022WCLC.MA06.03.
[3]Gisele Fraga Moreira,et al.OA08.03-Do in Screening-Calf Circumference and Muscle Strength is Predictive of Outcomes in Lung Cancer Treatment.2022WCLC.OA08.03.
本文首发:医学界肿瘤频道
本文作者:Lily
责任编辑:Sweet
| 留言与评论(共有 0 条评论) “” |