
神经母细胞瘤(NB)是最常见的儿童脑外实体瘤,约90%患者发病年龄<5岁,占儿童恶性肿瘤的8%~10%,其生物学行为多样,病因复杂。高危NB的肿瘤异质性更明显,治疗难度较大,近年来治疗手段不断进展,但目前综合治疗仍是其主要治疗方法。紧跟前沿,此次《医师报》特别邀请到中山大学孙逸仙纪念医院儿童医学中心副主任、肿瘤科主任黎阳教授分享高危NB患儿的诊治现状。

01
目前高危NB行综合治疗策略,然而患儿获益仍有待提高
根据患者起病年龄、肿瘤组织学类型、肿瘤分期等因素将NB划分为极低危、低危、中危和高危组别[1]。对于非高危患儿,治疗方法主要包括单纯观察、手术切除和中等剂量的化疗联合手术切除[2],预后较好,5年生存率高达85%~95%。而高危NB肿瘤异质性极强、生物学特征多样,目前国际上尚无统一的治疗方案。根据不同地区的实际情况、治疗手段的进步及临床的结果反馈,不同儿童肿瘤协作组制定的治疗方案也在不断改进。
现阶段,高危NB的治疗策略为综合治疗。治疗计划包括三个阶段,即诱导期(化疗和手术),巩固期(自体或异基因造血干细胞移植、针对原发肿瘤以及转移部位的放射治疗),巩固期后的维持治疗[免疫疗法和13-顺维甲酸(13-CRA)治疗]。
根据最新共识,高危NB诱导期需行共6个疗程的化疗,主要包括环磷酰胺(CTX)、阿霉素(DOXO)、拓扑替康(TOPO)等药物。一般而言,手术时机选择在完成4个化疗疗程后,手术应尽量切除原发病灶及区域内转移的淋巴结;多数NB治疗方案中的巩固治疗,包括自体造血干细胞移植(auto-HSCT)和清髓性化疗,其中auto-HSCT包括单次移植或序贯移植,目前国内部分单位尝试针对高危复发/难治性或者自体移植失败的NB患儿开展异基因造血干细胞移植(allo-HSCT),此种移植或可助力提高患儿的生存获益。
此外,针对高危NB患儿,需对原发肿瘤病灶以及残余转移部位进行放射治疗,以减少肿瘤原位复发率[3];维持治疗主要包括抗神经节苷脂(GD2)单抗免疫治疗联合应用粒细胞-巨噬细胞集落刺激因子(GM⁃CSF)和13-顺维甲酸(13⁃CRA)治疗。研究显示,GD2单抗免疫治疗联合GM⁃CSF应用可为高危NB患儿带来生存获益[4](图1),体外13-CRA可诱导NB细胞增殖分化为成熟细胞,从而失去恶性细胞的特征,并进一步提高患儿长期生存率[5]。目前高危NB患儿预后较差,5年生存率不足50%,且后期易复发和转移[6]。因此,高危NB治疗仍极具挑战。
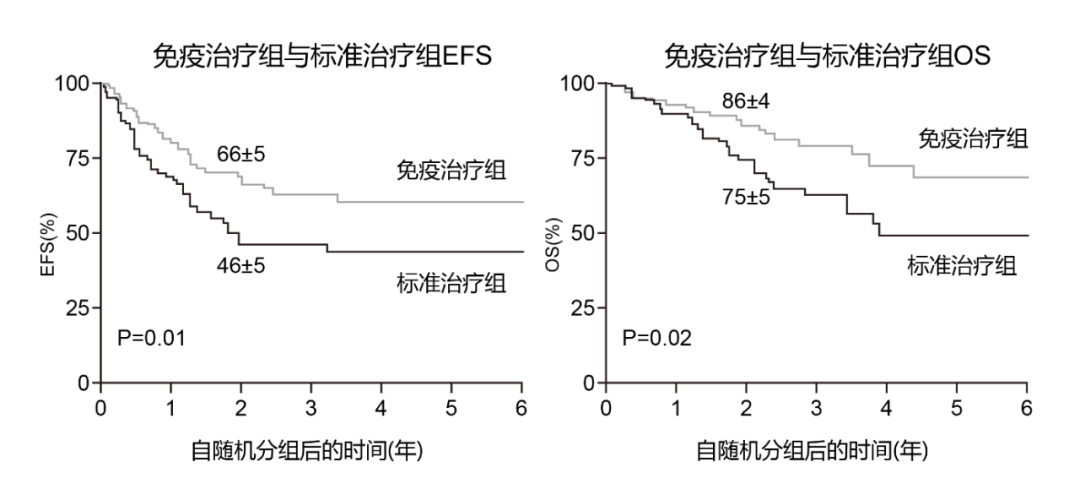
图1 免疫治疗组与标准治疗组无事件生存(EFS)率和总生存(OS)率对比[6]
02
高危NB患儿复发概率较大,有效治疗手段正不断探索
约50%的NB患儿经过诱导和巩固支持治疗后肿瘤复发[7],复发的因素与预后不良的因素相一致,包括确诊年龄≥18个月、形态学分类呈低分化、基于影像学的危险因子(IDRFs)如肿瘤包绕大动/静脉、肿瘤分期4期、MYCN基因扩增阳性、DNA倍性为多倍体等。对于孤立的局部复发病灶,尽管有相关报道通过手术切除肿瘤和(或)在疾病活动部位进行放疗达到成功治疗的目的,专家仍建议对复发NB患儿使用挽救性化疗方案。
目前国内外尚无明确针对复发NB有效的治疗方案,因此在放疗和化疗之余,各地医疗中心均在不断探索更有效提高复发NB患儿生存率的治疗手段。除了采用挽救性的化疗治疗方案,现阶段国内外针对复发NB的治疗方法还包括放射性核素治疗如131I⁃MIBG,基于二代测序结果的靶向药物治疗,GD2单抗治疗,嵌合抗原受体T细胞(CAR-T)治疗, auto-HSCT、allo-HSCT等。目前,中山大学孙逸仙纪念医院儿童医学中心肿瘤科及造血干细胞移植科经过前期的研究、探索,创新性地使用三氧化二砷(As2O3)联合化疗、allo-HSCT等手段治疗复发难治性高危NB患儿,相对传统治疗显现出了明显的疗效优势。
03
大剂量化疗联合造血干细胞移植,可改善患者生存
在高危NB患者巩固治疗中,使用大剂量化疗联合auto-HSCT可改善患者预后。传统的auto-HSCT中,采用CEM(卡铂、依托泊苷和马法兰)预处理方案,5年EFS(30±4% vs 19±3%)和OS(37±4% vs 28±4%)均优于单纯化疗;而白消安/马法兰清髓预处理方案较CEM方案进一步提高了5年EFS率(45%)和OS率(54%)。然而,国内auto-HSCT治疗高危NB的疗效欠佳,5年无病生存(DFS)率仅20.7%,5年OS率约34.5%。此外,高危NB常因微小残留病变(MRD)导致较高比例的复发或难治,临床上迫切需求可更有效清除MRD的巩固治疗手段。
而allo-HSCT后重建的供体免疫系统产生的移植物抗肿瘤(GVT)效应,可达到清除MRD与预防疾病复发的目的,现已证实allo-HSCT可通过GVT效应清除auto-HSCT后难治/复发性NB患者残余病灶,延长患儿的DFS。中山大学孙逸仙纪念医院儿童医学中心现阶段开展的allo-HSCT治疗4/M期高危NB取得的初步疗效令人鼓舞,即使小部分患儿接受allo-HSCT后仍会出现骨髓或骨残留病灶的复发,但其相对auto-HSCT后的复发也更容易通过后续的化疗得以成功控制;此外,allo-HSCT后使用GD2的抗体疗法也相对auto-HSCT能给高危NB患儿提供更为强烈的异体反应性免疫杀伤效应,显示allo-HSCT是突破目前auto-HSCT治疗4/M期高危NB疗效瓶颈的可行手段,可克服因长时间化疗、低龄、低体重等而无法采集足够自体干细胞进行auto-HSCT的技术劣势,同时为auto-HSCT后复发的患儿提供了技术兜底和挽救手段;随着造血干细胞移植技术的不断成熟、发展和进步,allo-HSCT将来有可能成为4/M期高危NB巩固治疗的一种新选择。
04
NB免疫治疗中GD2单抗脱颖而出,肿瘤疫苗前景可期
肿瘤疫苗属于肿瘤免疫治疗中的一种,不同于成人癌症许多经典的免疫检查点抑制剂(ICB)以及血液恶性肿瘤中的CAR-T细胞的优越疗效,大多数儿童实体肿瘤的免疫治疗几乎都折戟沉沙,例如NB至今尚未找到可直接作用于高危基因——MYCN基因的靶向药物。究其原因,可能是儿童相比于成人的实体肿瘤致癌基因突变负荷较小,肿瘤微环境中的免疫效应细胞功能相对不足,以及肿瘤起源多胚层受累等,导致其对单克隆抗体治疗、单一信号通路靶向药物治疗的应答率较低。
然而,针对GD2的抗体疗法是近年来NB治疗中特异性最强、应用最广泛的靶向免疫疗法。研究显示,GD2在NB细胞100 %高表达,为高危NB患儿理想的免疫治疗靶点,目前已有不少研究获得喜人成果,例如HR-NBL1/SIOPEN研究显示GD2单抗治疗高危NB的有效性(图2)[8]。
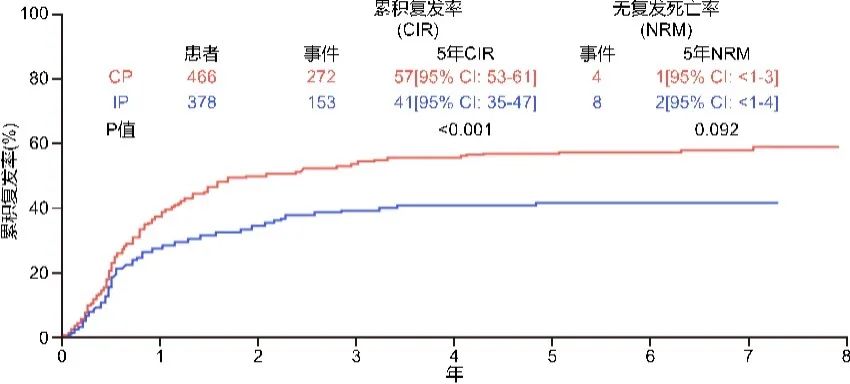
图2 GD2单抗治疗组与对照组5年累积复发率或疾病进展率(CIR)对比[8]
NB肿瘤疫苗是基于GD2靶点建立的一种新兴免疫疗法。肿瘤疫苗作为主动免疫,理论上优于单克隆抗体疗法,可利用单克隆抗体缺乏的协同抗体效应。此外,与单次注射单克隆抗体相比,患儿接种肿瘤疫苗形成免疫记忆后,机体持续存在抗肿瘤抗体,可有效控制肿瘤负荷如减少NB的肿瘤微残留。
因此,当前NB肿瘤疫苗的努力方向应为探索合适的疫苗佐剂,通过增强抗原提呈细胞对抗原的加工提呈,刺激淋巴细胞的增殖分化,以达到增强特异性免疫应答的效果。相信未来NB肿瘤疫苗定能成为部分NB患儿治疗的有效手段甚至主要手段。
05
黎阳教授总结
虽然分级诊断、综合治疗可在一定程度上提高高危NB患儿的生存率,但其较高的恶性程度及较强的复发/转移性,造成当前临床治疗的瓶颈。现阶段高危NB治疗仍任重而道远,有待进一步探索例如肿瘤疫苗等治疗策略,为更多NB患儿带来治愈希望。
专家简介

黎 阳 教授
中山大学孙逸仙纪念医院
副主任,肿瘤科主任
主任医师,博士生导师
中国医师协会儿科规培基地飞行检查评估专家
广东省抗癌协会小儿肿瘤专业委员会主任委员
广东省临床医学学会儿童实体肿瘤专业委员会副主任委员
发表相关领域第一作者(或通讯作者)论文70余篇,SCI收录10余篇
参考文献:(滑动查看)
1.MONCLAIR T, BRODEUR G M, AMBROS P F, et al. The international neuroblastoma risk group (INRG) staging system: an INRG task force report[J].Journal of Clinical Oncology Official Journal of the American Society of Clinical Oncology, 2009, 27 (2) :289-297.
2.BAKER D L, SCHMIDT M L, COHN S L, et al. Outcome after reduced chemotherapy for intermediate-risk neuroblastoma[J].New England Journal of Medicine, 2010, 363 (14) :1313.
3.Liu KX, Naranjo A, Zhang FF, et al. Prospective evaluation of radiation dose escalation in patients with high⁃risk neuroblastoma and gross residual disease after surgery: a report from the children's oncology group ANBL0532 study[J].J Clin Oncol,2020,38(24):2741⁃2752.
4.Yu AL, Gilman AL, Ozkaynak MF, et al. Anti⁃GD2 antibody with GM⁃CSF, interleukin⁃2,and isotretinoin for neuroblastoma[J].N Engl J Med,2010,363(14):1324⁃1334.
5.MATTHAYK K. Targeted isotretinoin in neuroblastoma: kinetics, genetics, or absorption[J].Clinical Cancer Research An Official Journal of the American Association for Cancer Research, 2013, 19 (2) :311-313.
6.Pandey G K, Kanduri C. Long noncoding RNAs and neuroblastoma[J]. Oncotarget, 2015, 6(21): 18265.
7.Matthay K K, Yanik G, Messina J, et al. Phase II study on the effect of disease sites, age, and prior therapy on response to iodine-131-metaiodobenzylguanidine therapy in refractory neuroblastoma[J]. Journal of clinical oncology, 2007, 25(9): 1054-1060.
8.Ladenstein R, Pötschger U, Valteau-Couanet D, et al. Investigation of the Role of Dinutuximab Beta-Based Immunotherapy in the SIOPEN High-Risk Neuroblastoma 1 Trial (HR-NBL1). Cancers (Basel), 2020 Jan 28, 12(2):309.

北上广杭4地8趟专列启航了!列车将搭载包含钟南山院士在内22位院士/国医大师/全国名中医、145位院管专家,1582人次医界精英的1220张公益巡展海报,进行为期一个月的巡展,将与超过2亿的乘客“亲密接触”!同时海报总视频将在北京1、2、5、8、13和八通线覆盖地铁、站台的1.3万台电视每天多次轮番播放,预计观看量超过1亿人次!
排版:李慧
编辑:王丽娜
| 留言与评论(共有 0 条评论) “” |