*仅供医学专业人士阅读参考
奥希替尼是肺癌治疗的利器,针对不同的耐药机制可采用相应的耐药处理方案。
作为三代EGFR-TKI,奥希替尼的出现解决了一代/二代EGFR-TKI的耐药问题,成为无数EGFR突变阳性晚期非小细胞肺癌(NSCLC)患者的“救命稻草”。同时,随着FLAURA研究结果的公布,奥希替尼一线治疗打破了无进展生存期(PFS)和总生存期(OS)的历史记录,显著延长了患者的生存时间。然而,奥希替尼治疗也不可避免地会出现耐药。
之前我们已经和大家分享了奥希替尼主要耐药机制C797S和MET扩增的应对策略,本文将继续介绍HER2扩增/突变在奥希替尼一线治疗耐药后的发生情况和解决方案,让临床医生对“耐药无忧”,放心“好药先行”,并最终更好地造福广大肺癌患者。
奥希替尼一线治疗,刷新PFS和OS历史记录
FLAURA研究是一项随机、对照、多中心、双盲的Ⅲ期临床试验,旨在探索奥希替尼对比一代EGFR-TKI一线治疗EGFR突变阳性的局部晚期或转移性NSCLC患者。主要终点为研究者评估的PFS,OS为关键次要终点。
从FLAURA研究数据可以看到,与一代 EGFR-TKI相比,奥希替尼一线治疗EGFR突变阳性晚期NSCLC患者显著延长PFS至18.9个月,降低54%的疾病进展或死亡风险(HR=0.46,95%CI:0.37-0.57),且各个亚组都有获益[1]。此外,奥希替尼一线治疗的中位OS达38.6个月,突破了EGFR-TKI单药治疗的最长OS记录[2]。
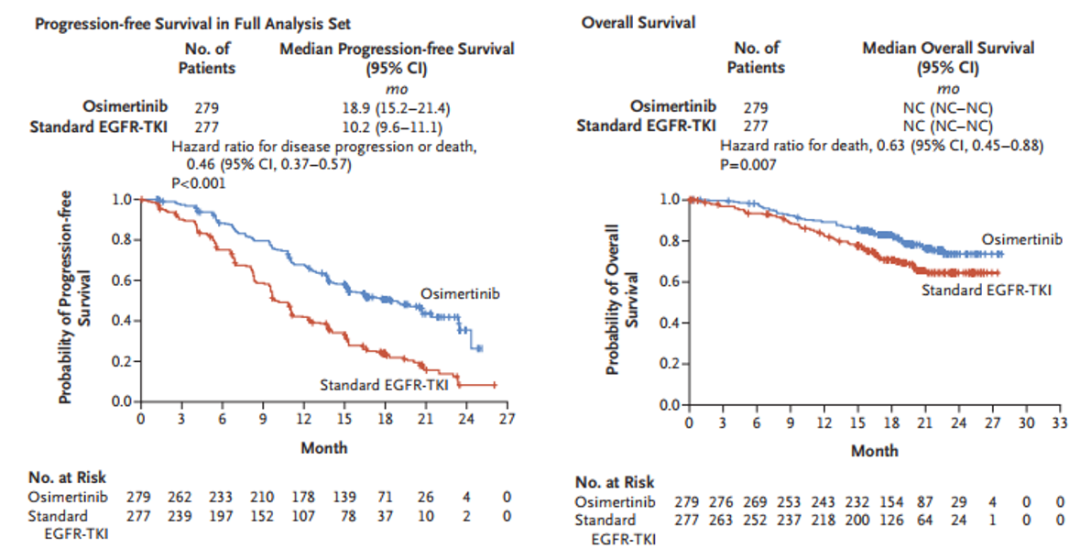
图1. FLAURA研究中总人群奥希替尼一线治疗的PFS和OS结果
奥希替尼在预防中枢神经系统(CNS)转移方面也具有优势。对于基线存在CNS转移的患者,相比一代EGFR-TKI,奥希替尼显著延长中位PFS至15.2月,降低53%的疾病进展风险(P<0.001)[1]。
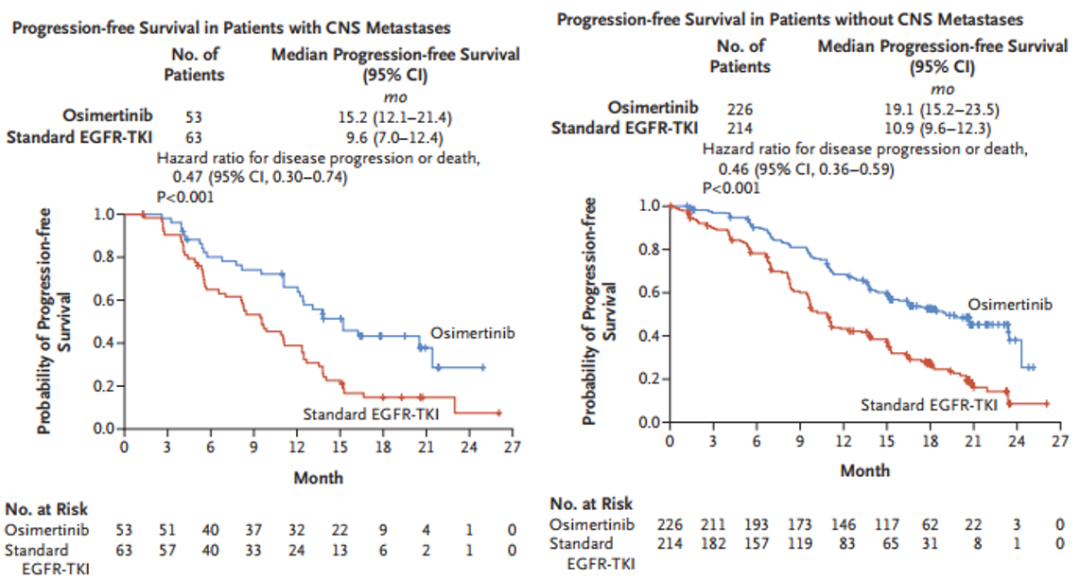
图2. FLAURA研究中伴和不伴基线CNS转移患者奥希替尼一线治疗的PFS和OS结果
目前多部国内外权威指南均推荐奥希替尼作为EGFR突变阳性患者的标准一线治疗方案,其中美国国家综合癌症网络(NCCN)指南为优选推荐,欧洲肿瘤内科学会(ESMO)指南为IA级、最高分推荐,中国临床肿瘤学会(CSCO)指南为I级推荐。

图3. 奥希替尼一线治疗获得国内外指南一致推荐
HER2扩增/突变与奥希替尼一线治疗耐药
HER2是一种酪氨酸激酶受体,属于EGFR家族。在不同的HER家族蛋白中,HER2的催化激酶活性最强[3,4]。其磷酸化可导致PI3-Akt、MAPK和ERK MET/MAPK通路的下游激活[5-7]。HER2变异在NSCLC中主要包括扩增和突变两种形式,两者都会导致HER2激活[8]。
HER2变异是NSCLC的致癌驱动基因,也是EGFR-TKI获得性耐药的重要机制。临床研究表明,HER2变异是奥希替尼获得性耐药机制之一。在FLAURA研究中,奥希替尼一线治疗耐药后,有2%的患者发生HER2扩增,1%的患者发生HER2突变[9]。此外,AURA3研究显示,奥希替尼一线治疗耐药后有5%的患者发生HER2扩增,而且部分患者合并有其他靶点突变[10]。不过相比而言,HER2扩增在一代EGFR-TKI(厄洛替尼、吉非替尼)一线治疗耐药后更为常见,发生率约10%[11]。
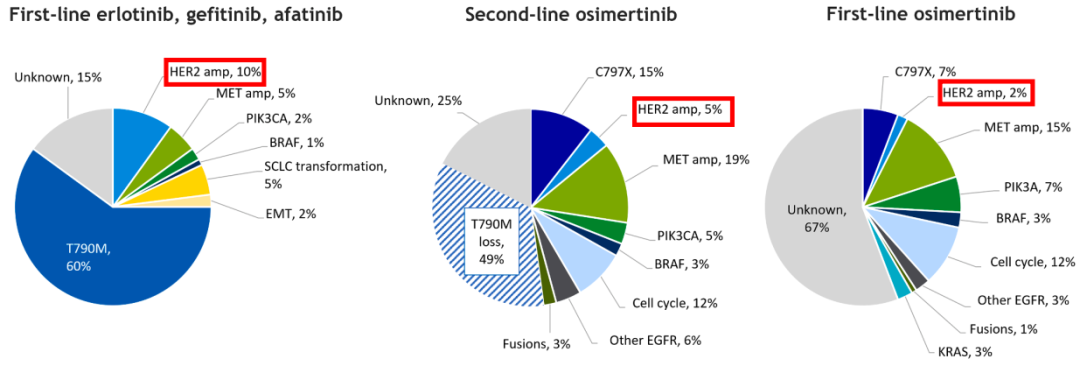
图4. EGFR突变NSCLC中引起TKI耐药的突变和扩增发生情况[12]
见招拆招,破解奥希替尼一线治疗耐药后HER2扩增/突变
那么对于奥希替尼一线治疗耐药后HER2扩增/突变的晚期NSCLC患者,临床上该如何治疗呢?目前已经有多项研究对此进行了探索,并且抗HER2单抗、TKI类药物及抗体偶联药物(ADC)等多种治疗方案已显示出较好的应用前景。
01
抗HER2单抗
一项单臂、Ⅱ期研究评价了曲妥珠单抗联合紫杉醇在EGFR-TKI治疗进展后表达HER2的NSCLC患者中的疗效和安全性,结果发现,总体客观缓解率(ORR)为46%,并且在4例HER2扩增(&10 copies/nucleus)的患者中观察到100%的缓解率[13]。
02
TKI类药物
吡咯替尼是一种不可逆的泛HER酪氨酸激酶抑制剂(TKI),靶点包括EGFR/HER1、HER2和HER4。一项Ⅱ期研究纳入60例HER2 20号外显子插入突变且接受过至少一种含铂方案化疗的IIIB和IV期NSCLC患者,接受每日400mg吡咯替尼治疗。结果显示,吡咯替尼单药具有可接受的安全性特征和有前景的抗肿瘤活性,ORR为30%;中位PFS为6.9个月,中位OS为14.4个月[14]。
Ⅱ期PATHER2研究则进一步探索了吡咯替尼联合抗血管生成药物阿帕替尼治疗HER2扩增或突变晚期NSCLC,结果显示,吡咯替尼联合阿帕替尼治疗的ORR为45.5%,疾病控制率(DCR)为93.9%[15]。
此外,Ⅱ期ZENITH20-2研究显示,另一种泛HER-TKI类药物Poziotinib后线治疗HER2 20号外显子插入突变NSCLC的ORR为28%,中位PFS为5.5个月[16]。
03
ADC类药物
Trastuzumab emtansine(T-DM1)是一种由抗HER2抗体、不可切割连接子、有效载荷组成的ADC类药物。临床前研究显示,T-DM1可能克服奥希替尼耐药[17]。一项Ⅱ期研究纳入既往接受过EGFR-TKI治疗的患者,给予T-DM1治疗,并在HER2免疫组化(IHC)3+的4例患者中观察到部分缓解(PR),ORR为20%[18]。此外,一项Ⅱ期“篮子”研究发现,在18例接受过多线治疗的HER2突变肺癌患者中,T-DM1治疗的ORR为44%,中位PFS为5个月[19]。
另一种ADC类药物Trastuzumab deruxtecan(T-DXd)在HER2表达或HER2突变NSCLC患者中也显示中较好的抗肿瘤活性。在一项Ⅰ期研究的HER2表达或HER2突变NSCLC患者队列中,T-DXd治疗的ORR为55.6%,中位PFS为11.3个月[20]。Ⅱ期DESTINY-Lung01研究显示,在已接受过当前标准治疗的HER2突变NSCLC患者中,T-DXd治疗的经确认ORR为55%,中位PFS为8.2个月[21]。
另外,II期DESTINY-Lung02研究纳入在既往全身治疗后疾病进展的不可切除或转移性 HER2突变的非鳞状NSCLC患者,给予T-DXd治疗。在包含52例患者的主要疗效分析队列中,ORR为58%,中位缓解持续时间(DOR)为8.7个月[22]。基于该研究结果,T-DXd于2022年8月获得美国食品药品监督管理局批准,用于既往接受过全身治疗的HER2突变不可切除或转移性NSCLC成人患者,成为首个获批用于HER2突变NSCLC的治疗药物。
04
其他
除了抗HER2治疗外,免疫治疗也在HER2突变NSCLC中显示中一定的临床活性。一项回顾性研究发现,免疫联合化疗一线治疗HER2突变NSCLC的ORR为52%,中位PFS为6个月[23]。
HER2 16号外显子跳跃突变作为奥希替尼耐药的一种新型机制,体外研究显示阿法替尼联合奥希替尼可以抑制肿瘤细胞生长和信号传导[24,25]。
专家点评:多种新药、新方案涌现,克服HER2扩增/突变所致奥希替尼耐药前景可期
HER2扩增/突变是奥希替尼耐药的重要机制,以往临床上对于此类患者的治疗以化疗为主,但效果并不理想。目前,虽然关于奥希替尼耐药后获得性HER2扩增/突变的治疗尚未达成共识,但随着各种新药、新方案的不断研发,给临床治疗带来了更多的选择。比如抗HER2单抗曲妥珠单抗、TKI类药物吡咯替尼和Poziotinib、ADC类药物T-DM1和T-DXd、免疫治疗以及奥希替尼联合方案等,已经在临床研究中显示出有前景的抗肿瘤活性,并且T-DXd已获得美国FDA批准用于HER2突变NSCLC治疗。未来期待这些新药、新方案能够开展更多研究,不断积累用于奥希替尼耐药后HER2扩增/突变NSCLC患者的循证医学证据,为临床治疗提供指导。
专家简介

蔡勇 教授
同济大学附属上海市肺科医院放疗科副主任
主任医师 硕士研究生导师 医学博士
中国医药教育协会肺部肿瘤专委会常务委员
中国肺癌防治联盟立体定向专委会常务委员
吴阶平医学基金会肿瘤放疗专委会委员
世界华人肿瘤医师协会肺癌工作委会委员
宋庆龄基金会肿瘤医疗及区域产学研联盟理事
中国老年学和老年医学学会精准医疗分会委员
上海市抗癌协会放疗青委会委员
上海市医药卫生青年联合会委员
参考文献:
[1].Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N Engl J Med. 2018 Jan 11;378(2):113-125.
[2].S.S. Ramalingam, J.E. Gray, Y. Ohe, et al. Osimertinib vs comparator EGFR-TKI as first-line treatment for EGFRm advanced NSCLC (FLAURA): Final overall survival analysis. Annals of Oncology (2019) 30 (suppl_5): v851-v934.
[3].Hsu C-C, et al. Exon 16–Skipping HER2 as a Novel Mechanism of Osimertinib Resistance in EGFR L858R/T790M–Positive Non–Small Cell Lung Cancer. J. Thorac. Oncol. 2019, 15,50–61.
[4].Yan M, et al. R. HER2 expression status in diverse cancers: Review of results from 37,992 patients. Cancer Metastasis Rev. 2015, 34, 157–164.
[5].Planchard D, et al. Correction to: “Metastatic non-small cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up”. Ann. Oncol. 2019, 30, 863–870.
[6].Lamberti G, et al. Beyond EGFR, ALK and ROS1: Current evidence and future perspectives on newly targetable oncogenic drivers in lung adenocarcinoma. Crit. Rev. Oncol. 2020, 156, 103119.
[7].Paez J G, et al. EGFR Mutations in Lung Cancer: Correlation with Clinical Response to Gefitinib Therapy. Science 2004, 304, 1497–1500.
[8].Midha A, et al. EGFR mutation incidence in non-small-cell lung cancer of adenocarcinoma histology: A systematic review and global map by ethnicity (mutMapII). Am. J. Cancer Res. 2015, 5, 2892–2911.
[9].Ramalingam S.S, et al. Mechanisms of acquired resistance to first-line osimertinib: Preliminary data from the phase III FLAURA study. Ann. Oncol. 2018, 29, viii740.
[10].Papadimitrakopoulou V.A, et al. Analysis of resistance mechanisms to osimertinib in patients with EGFR T790M advanced NSCLC from the AURA3 study. Ann. Oncol. 2018, 29, viii741.
[11].Wu SG, Shih JY. Management of acquired resistance to EGFR TKI-targeted therapy in advanced non-small cell lung cancer. Mol Cancer. 2018;17(1):38.
[12].Johnson M, et al. Treatment strategies and outcomes for patients with EGFR-mutant non-small cell lung cancer resistant to EGFR tyrosine kinase inhibitors: Focus on novel therapies. Lung Cancer. 2022;170:41-51.
[13].de Langen AJ, Jebbink M, Hashemi SMS, et al. Trastuzumab and paclitaxel in patients with EGFR mutated NSCLC that express HER2 after progression on EGFR TKI treatment. Br J Cancer 2018; 119:558–564.
[14].Zhou C, Li X, Wang Q, et al. Pyrotinib in HER2-Mutant Advanced Lung Adenocarcinoma after Platinum-based Chemotherapy: A Multicenter, Open-label, Single-arm, Phase II study. J Clin Oncol. 2020;38(24):2753-61.
[15].Yang G, Xu H, Yang L, et al. Efficacy and safety of pan-ErbB inhibitor pyrotinib combined with antiangiogenic agent apatinib for HER2-mutant or amplified metastatic NSCLC: a phase II clinical study. J Clin Oncol 2021; 39(15 Suppl):9035.
[16].Le X, Cornelissen R, Garassino M, et al. Poziotinib in Non-Small-Cell Lung Cancer Harboring HER2 Exon 20 Insertion Mutations After Prior Therapies: ZENITH20-2 Trial. J Clin Oncol. 2022;40(7):710-718.
[17].S. La Monica, D. Cretella, M. Bonelli, et al. Trastuzumab emtansine delays and overcomes resistance to the third-generation EGFR-TKI osimertinib in NSCLC EGFR mutated cell lines, J. Exp. Clin. Cancer Res. 36 (1) (2017) 174.
[18].S. Peters, R. Stahel, L. Bubendorf, et al. Trastuzumab Emtansine (TDM1) in Patients with Previously Treated HER2-Overexpressing Metastatic NonSmall Cell Lung Cancer: Efficacy, Safety, and Biomarkers, Clin Cancer Res 25 (1) (2019) 64–72.
[19].B.T. Li, R. Shen, D. Buonocore, et al. Ado-Trastuzumab Emtansine for Patients With HER2-Mutant Lung Cancers: Results From a Phase II Basket Trial, J. Clin. Oncol. 36 (24) (2018) 2532–2537.
[20].J. Tsurutani, H. Iwata, I. Krop, et al. Targeting HER2 with Trastuzumab Deruxtecan: A Dose-Expansion, Phase I Study in Multiple Advanced Solid Tumors, Cancer Discov, 2020.
[21].B.T. Li, E.F. Smit, et al. Trastuzumab Deruxtecan in HER2-Mutant Non-Small-Cell Lung Cancer, N Engl J Med. 386 (3) (2022) 241–251.
[22].https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-fam-trastuzumab-deruxtecan-nxki-her2-mutant-non-small-cell-lung
[23].Saalfeld FC, Wenzel C, Christopoulos P, et al. Efficacy of immune checkpoint inhibitors alone or in combination with chemotherapy in NSCLC harboring ERBB2 mutations. J Thorac Oncol 2021. S1556-0864(21)02292-9.
[24].Offin M, Somwar R, Rekhtman N, et al. Acquired ALK and RET gene fusions as mechanisms of resistance to osimertinib in EGFR-mutant lung cancers. JCO Precis Oncol 2018; 2:1–12.
[25].Zeng L, Yang N, Zhang Y. GOPC-ROS1 rearrangement as an acquired resistance mechanism to osimertinib and responding to crizotinib combined treatments in lung adenocarcinoma. J Thorac Oncol 2018; 13:e114–e116.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |