*仅供医学专业人士阅读参考
追踪DESTINY-Gastric02研究最新随访数据,OS达12.1月,安全性可靠。
2022年欧洲肿瘤内科学会(ESMO)大会于巴黎时间9月9日至13日举行,已完美落幕。消化道肿瘤领域的研究进展精彩纷呈,其中,评估T-DXd在HER2阳性晚期胃癌二线治疗效果的DESTINY-Gastric02研究荣登ESMO“Mini Oral”专场,公布总生存期(OS)、患者报告结局(PRO)及更新的安全性数据[1]。本文总结了HER2阳性晚期胃癌现有的二线药物治疗进展和未来潜在的发展方向,并详细解读DESTINY-Gastric 02研究结果,为HER2阳性晚期胃癌二线治疗提供依据。
困局——HER2阳性晚期胃癌
二线治疗现状及临床困境
根据2020年GLOBOCAN数据,中国胃癌占世界新发病例的43.9%,占世界死亡病例的48.6%[2]。并且,我国胃癌的5年生存率仅为35.9%,远低于日韩国家[3],亟待提高。ToGA Ⅲ期研究的成功奠定了曲妥珠单抗在HER2阳性晚期胃癌的治疗地位[4],曲妥珠单抗联合化疗成为HER2阳性晚期胃癌一线治疗方案,自此胃癌进入靶向治疗时代。
在此之后的近十年,以HER2为靶点的药物在HER2阳性晚期胃癌的探索步履维艰,多以失败告终。在未经曲妥珠单抗治疗的患者中,酪氨酸激酶抑制剂(TKI,拉帕替尼)以及第二代ADC药物(T-DM1)均未能改善HER2阳性晚期胃癌二线治疗的生存获益[5,6]。同时一项Meta分析显示,在曲妥珠单抗治疗失败的患者中,近年国内外的Ⅱ期研究和回顾性研究结果显示曲妥珠单抗跨线治疗价值存在争议,缺乏高级别循证医学依据,故不支持跨线治疗[7]。
回顾2022年中国临床肿瘤学会(CSCO)胃癌诊疗指南发现,HER2阳性晚期胃癌的二线治疗推荐方案主要为雷莫西尤单抗联合紫杉醇或其他单药化疗,尚无标准抗HER2药物[8]。并且,二线治疗的疗效个体差异较大,中位OS仅为5.2-9.5个月,客观缓解率(ORR)为9.3%-26.5%[9-12]。总体而言,HER2阳性晚期胃癌二线治疗缺乏有效的治疗方案,存在巨大的未满足需求。
破局——T-DXd为HER2阳性
晚期胃癌二线治疗带来新突破
2022年第二版美国国立综合癌症网络(NCCN)胃癌指南及2022年ESMO胃癌诊疗指南中推荐的T-DXd是唯一将HER2阳性晚期胃癌二线治疗的OS提升至1年以上的药物[13,14]。上述推荐基于DESTINY-Gastric01研究中令人惊艳的疗效,经曲妥珠单抗治疗进展的HER2阳性晚期三线及以上胃癌患者,使用T-DXd治疗中位OS长达12.5个月,相比化疗组(8.9个月)明显延长;ORR为51.3%,是化疗组(14.3%)的3倍多[15]。并且基于此,T-DXd已获批HER2阳性晚期胃癌适应症(美国FDA≥2线,日本MHLW≥3线)。
DESTINY-Gastric02研究是T-DXd的另一项开放标签、单臂Ⅱ期研究,纳入一线含曲妥珠单抗治疗后进展的HER2阳性不可切除或转移性胃及胃食管交界处腺癌(以下简称晚期胃癌),评估T-DXd二线单药治疗在西方人群的疗效和安全性[1]。主要纳入标准包括:1)经病理证实不可切除或转移性晚期胃癌;2)中心实验室验证的HER2阳性患者(IHC3+或IHC2+/ISH+):标本取样于一线含曲妥珠单抗治疗后进展;3)ECOG PS评分0或1。主要研究终点为独立中心审查委员会(ICR)评估的ORR,次要研究终点包括ICR评估的无进展生存期(PFS)、OS、缓解持续时间(DoR)、安全性及PRO。

图1.DESTINY-Gastric02研究设计[1]
该研究共入组79例患者,超过一半的患者(63.3%)ECOG PS为1,65.8%的患者为胃食管结合部癌,93.7%的患者至少存在2个转移灶,63.3%的患者基线时存在肝转移。整体而言,入组患者基线较差。2021年ESMO年会中报道的首次分析数据显示[16],截至2021年4月9日,中位随访时间为5.9个月,确证的ORR达38%,中位DoR长达8.1个月,疾病控制率(DCR)为81%,中位PFS为5.5个月。
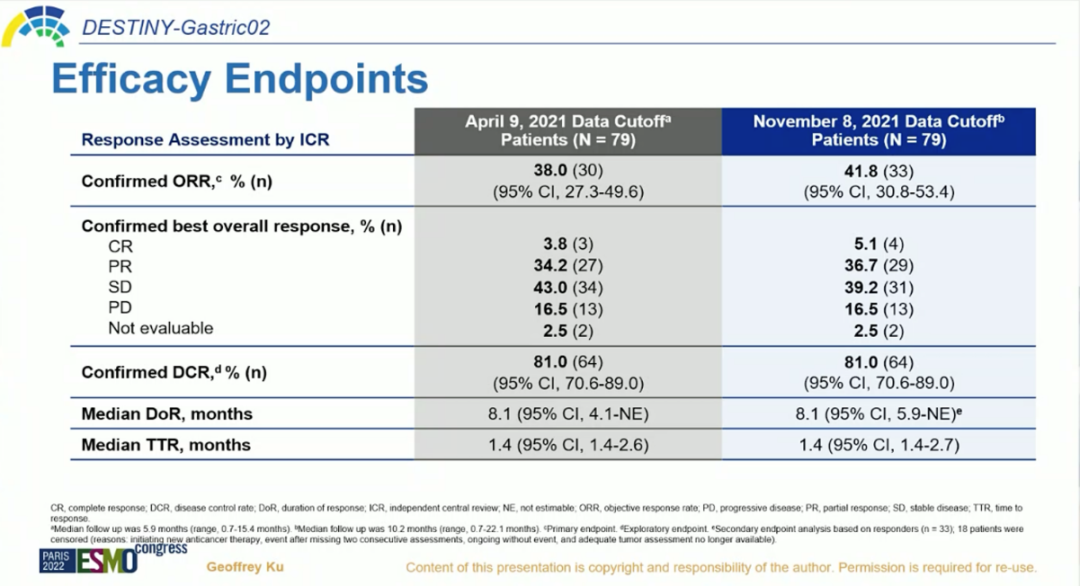
图2.DESTINY-Gastric02研究结果[1]
2022年ESMO大会中更新的研究数据显示,截至2021年8月,中位随访时间10.2个月,ICR确证的ORR为41.8%,其中5.1%的患者达到完全缓解(CR),36.7%的患者实现部分缓解(PR),39.2%的患者获得疾病稳定(SD)。确证的DCR为81.0%,中位DoR为8.1个月,中位应答时间(TTR)为1.4个月。中位OS为12.1个月,中位PFS为5.6个月[1]。
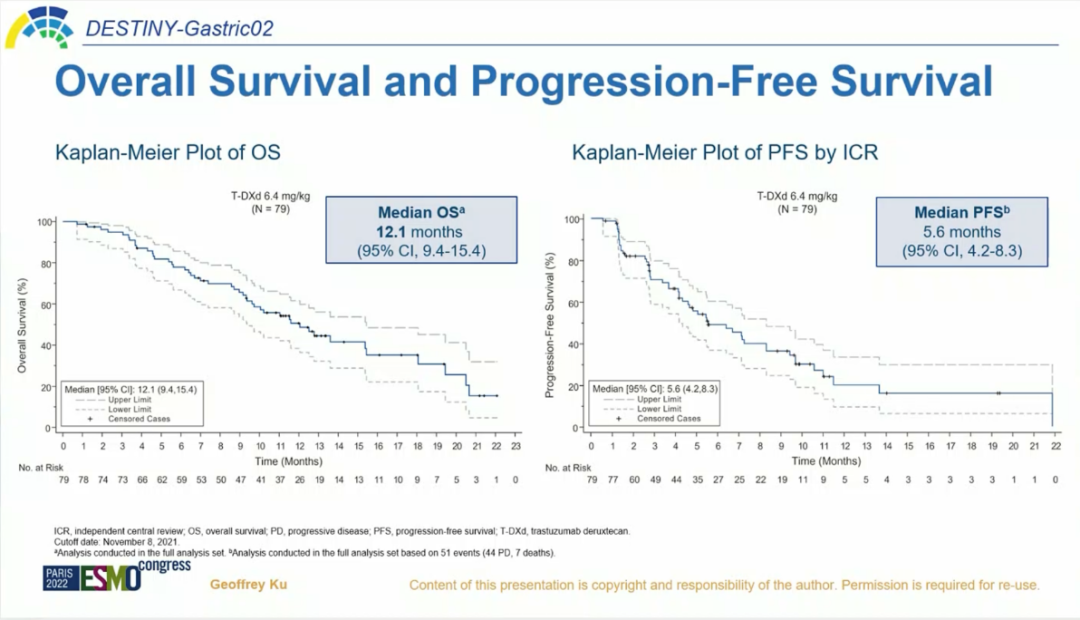
图3.OS及PFS获益[1]
在安全性方面,中位治疗持续时间为4.3个月。任意级别药物相关TEAEs发生率为94.9%,≥3级药物相关TEAEs发生率为30.4%。最常见的TEAEs为恶心67.1%、呕吐44.3%和疲劳41.8%。药物相关的间质性肺病/肺炎(ILD)的发生率为10.1%(8/79),其中有6例(7.6%)患者是1-2级,2例(2.5%)患者是5级,大部分患者的ILD可控。确定的药物相关ILD的中位发生时间为80.5天,中位持续时间为36天,均与初期分析结果基本一致。表明随着随访时间延长,T-DXd二线治疗HER2阳性晚期胃癌在西方人群中持续获益,并且不良反应可耐受[1]。
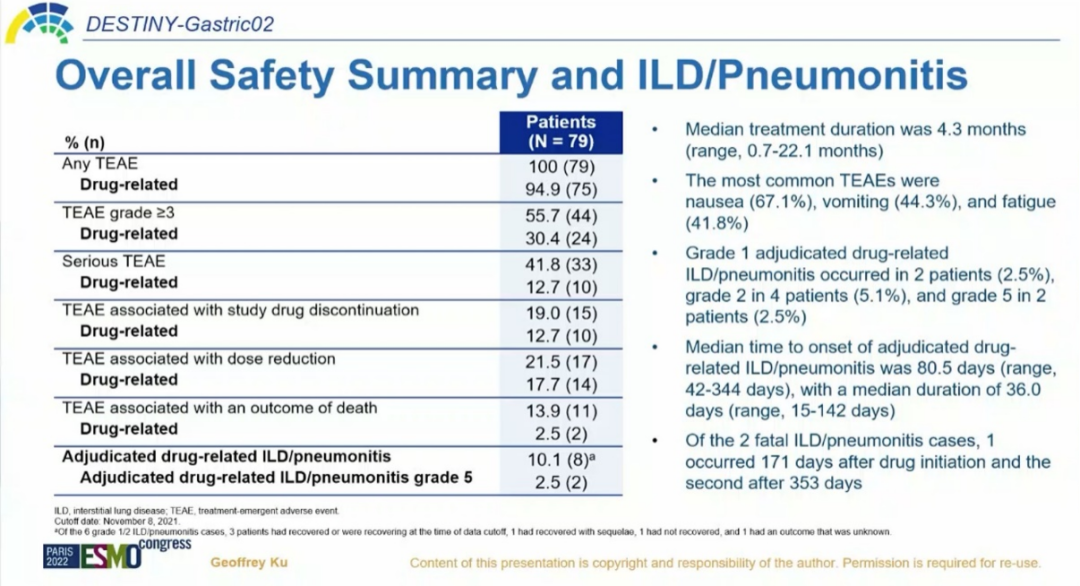
图4.安全性数据[1]
PRO是临床结局的形式之一,以患者为中心,强调患者的体验、观点和需求,由患者直接报告其在治疗过程中对自身疾病和相应治疗的感受,是对现有临床试验非常重要的补充[17]。在本次ESMO大会中也公布了DESTINY-Gastric02研究的PRO数据,从患者角度展现T-DXd的临床获益。截至2021年4月9日,根据EQ-5D和FACT-Ga(胃癌治疗功能评估量表)量表评估,与基线比较,T-DXd治疗至第7周期时健康相关生活质量(HRQoL)无明显变化[1]。由此说明,随着随访时间延长,T-DXd治疗可维持HER2阳性晚期胃癌患者生活质量。
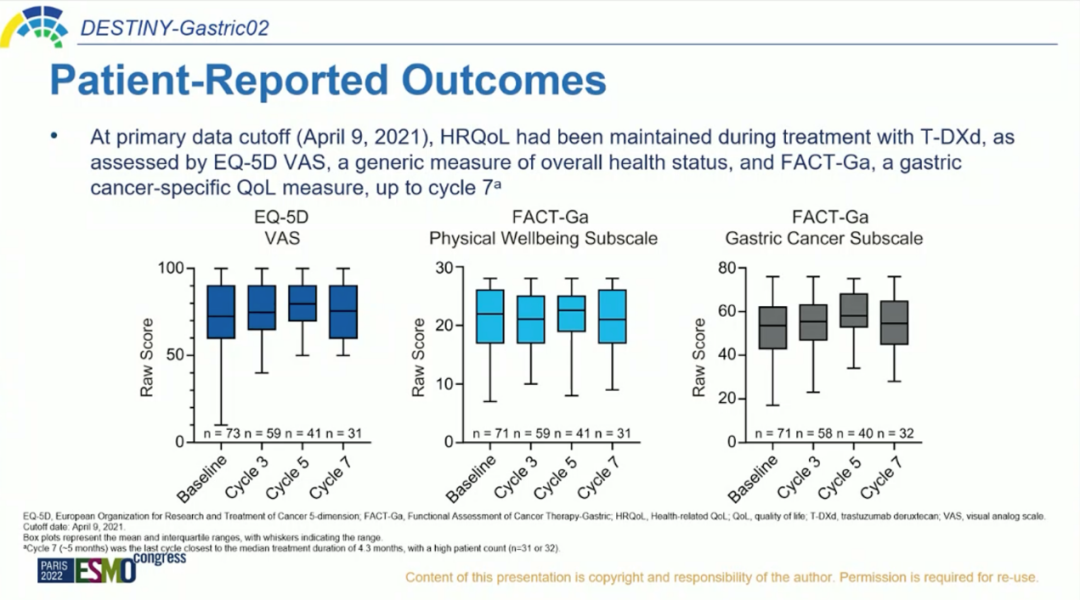
图5.PRO获益[1]
DESTINY-Gastric02研究不仅在受试者分布方面补充了西方人群的数据(DESTINY-Gastric01仅纳入亚洲人群);初期分析结果已经证实T-DXd在HER2阳性晚期胃癌二线治疗中疗效显著且安全性可靠;本次ESMO大会更新的数据显示,经T-DXd二线治疗,HER2阳性晚期胃癌患者ORR高达41.8%、OS突破1年,是目前HER2阳性胃癌二线治疗方案中的最高记录;并且在治疗过程中HRQoL得以维持。进一步揭示了T-DXd二线治疗HER2阳性晚期胃癌的广阔前景。
总结与展望——HER2阳性
晚期胃癌二线治疗的未来格局
中国拥有全球最为庞大的胃癌患者群体,并且总体生存率堪忧。根据2022年CSCO胃癌诊疗指南,在HER2阳性晚期胃癌患者中,使用以曲妥珠单抗为基础的联合方案一线治疗失败后缺乏有效的后线治疗手段。基于DESTINY-Gastric01研究的优异表现,2022年NCCN及ESMO指南推荐T-DXd用于HER2阳性晚期胃癌二线及以后治疗。本次ESMO大会更新的DESTINY-Gastric02研究表明,T-DXd在HER2阳性晚期胃癌二线治疗中取得ORR和OS的双重突破,是第一个OS突破1年的HER2阳性晚期胃癌二线治疗药物,并且在整个治疗过程中患者HRQoL得以维持。为T-DXd成为HER2阳性晚期胃癌二线治疗的标准方案提供循证医学证据。
正在进行的全球、多中心、随机、开放标签、Ⅲ期DESTINY-Gastric04临床研究,头对头比较T-DXd单药与雷莫西尤单抗+紫杉醇在曲妥珠单抗经治的HER2阳性晚期胃癌的差异[18],将进一步稳固T-DXd在HER2阳性晚期胃癌的二线治疗地位。从目前的研究进展来看,以T-DXd为代表的ADC药物、TKI、以及双特异性抗体等都在HER2阳性晚期胃癌二线治疗中进行积极探索。未来随着这些新型药物研究数据的公布,相信可以为HER2阳性晚期胃癌患者带来更多新的治疗选择,延长生存时间,提高生活质量。
专家简介

郭伟剑 教授
博士,主任医师,博士生导师
复旦大学附属肿瘤医院消化肿瘤内科主任
中国临床肿瘤学会(CSCO)理事
中国临床肿瘤学会胰腺癌专委会常委
中国抗癌协会精准治疗专委会常委
中国抗癌协会胃癌专委会委员
中国临床肿瘤学会胃癌专委会委员
上海市抗癌协会癌症康复与姑息治疗专委会主任委员
上海市抗癌协会胃癌分子靶向与免疫治疗专委会副主任委员
上海市抗癌协会肠癌专委会常委、转移学组副组长
承担多项国家自然科学基金、科技部新药创制重大专项子课题,曾获教育部科技进步二等奖
参考文献:
[1]Updated analysis of DESTINY-Gastric02:A phase II single-arm trial of trastuzumab deruxtecan(T-DXd)in western patients(Pts)with HER2-positive(HER2+)unresectable/metastatic gastric/gastroesophageal junction(GEJ)cancer who progressed on or after trastuzumab-containing regimen.2022 ESMO 1205MO.
[2]Sung H,Ferlay J,Siegel RL,et al.Global Cancer Statistics 2020:GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries.CA Cancer J Clin.2021 May;71(3):209-249.
[3]Allemani C,Matsuda T,Di Carlo V,et al.Global surveillance of trends in cancer survival 2000-14(CONCORD-3):analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries.Lancet.2018 Mar 17;391(10125):1023-1075.
[4]Bang YJ,Van Cutsem E,Feyereislova A,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer(ToGA):a phase 3,open-label,randomised controlled trial.Lancet.2010 Aug 28;376(9742):687-97.
[5]Satoh T,Xu RH,Chung HC,et al.Lapatinib plus paclitaxel versus paclitaxel alone in the second-line treatment of HER2-amplified advanced gastric cancer in Asian populations:TyTAN--a randomized,phase III study.J Clin Oncol.2014 Jul 1;32(19):2039-49.
[6]Thuss-Patience PC,Shah MA,Ohtsu A,et al.Trastuzumab emtansine versus taxane use for previously treated HER2-positive locally advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma(GATSBY):an international randomised,open-label,adaptive,phase 2/3 study.Lancet Oncol.2017 May;18(5):640-653.
[7]Palle J,Rochand A,Pernot S,Gallois C,Taïeb J,Zaanan A.Human Epidermal Growth Factor Receptor 2(HER2)in Advanced Gastric Cancer:Current Knowledge and Future Perspectives.Drugs.2020 Mar;80(4):401-415.
[8]中国临床肿瘤学会指南工作委员会.中国临床肿瘤学会(CSCO)胃癌诊疗指南2022[M].北京:人民卫生出版社,2022.
[9]Li Q,Jiang H,Li H,et al.Efficacy of trastuzumab beyond progression in HER2 positive advanced gastric cancer:a multicenter prospective observational cohort study.Oncotarget.2016 Aug 2;7(31):50656-50665.
[10]Hironaka S,Ueda S,Yasui H,et al.Randomized,open-label,phase III study comparing irinotecan with paclitaxel in patients with advanced gastric cancer without severe peritoneal metastasis after failure of prior combination chemotherapy using fluoropyrimidine plus platinum:WJOG 4007 trial.J Clin Oncol.2013 Dec 10;31(35):4438-44.
[11]RAINBOW-Asia:A randomized,multicenter,double-blind,phase 3 study of ramucirumab plus paclitaxel versus placebo plus paclitaxel in the treatment of advanced gastric or gastroesophageal junction(GEJ)adenocarcinoma following disease progression on first-line chemotherapy with platinum and fluoropyrimidine.2021 ASCO GI.Abstract 199.
[12]Kang JH,Lee SI,Lim DH,et al.Salvage chemotherapy for pretreated gastric cancer:a randomized phase III trial comparing chemotherapy plus best supportive care with best supportive care alone.J Clin Oncol.2012 May 1;30(13):1513-8.
[13]NCCN Gastric Cancer.2022 V2.
[14]Lordick F,Carneiro F,Cascinu S,et al.Gastric cancer:ESMO Clinical Practice Guideline for diagnosis,treatment and follow-up.Ann Oncol.2022 Jul 29:S0923-7534(22)01851-8.
[15]Shitara K,Bang YJ,Iwasa S,et al;DESTINY-Gastric01 Investigators.Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer.N Engl J Med.2020 Jun 18;382(25):2419-2430.
[16]Primary Analysis of a Phase 2 Single-Arm Trial of Trastuzumab Deruxtecan(T-DXd)in Western Patients With HER2-Positive(HER2+)Unresectable or Metastatic Gastric or Gastroesophageal Junction(GEJ)Cancer Who Progressed on or After a Trastuzumab-containing Regimen.2021 ESMO.Abstract LBA55.
[17]国家药监局药审中心《患者报告结局在药物临床研究中应用的指导原则(试行)》https://www.ccfdie.org/cn/yjxx/yphzp/webinfo/2022/01/1640591393226969.htm
[18]https://clinicaltrials.gov/ct2/show/NCT04704934
*此文仅用于向医学人士提供科学信息,不代表本平台观点

| 留言与评论(共有 0 条评论) “” |