
撰文 | Qi
#黑色素瘤#
原发性黑色素瘤是一种常见疾病,大多数不会发生转移,但一旦转移到远端器官通常会导致患者死亡。目前仍然缺乏有效的转移瘤治疗策略,因此研究人员着眼于预测哪些肿瘤最终会发生或不发生转移。多种临床因素比如溃疡、肿瘤累及淋巴结的范围可以提供一定的预后信息,包括机器学习/人工智能在内的方法的进步也进一步增强了预测能力。此外,人们愈发认识到转移与表观遗传和转录的相关性,已开始研究基因特征,但究竟哪些转录变化是转移过程中的驱动因素哪些是乘客因素还不得而知。
近日,来自纪念斯隆-凯特琳癌症中心的Richard M. White团队在Cancer Discovery杂志上发表了一篇题为Identifying the transcriptional drivers of metastasis embedded within localized melanoma 的文章,他们利用原发性黑色素瘤的斑马鱼模型,结合AVAST-M数据来确定与转移相关的基因特征,并将胆固醇转移蛋白GRAMD1B确定为转移抑制因子。就机制而言,过量的游离胆固醇或其代谢物27-羟基胆固醇通过激活AP-1程序来促进肿瘤转移。总之,这项工作强调了GRAMD1B作为黑色素瘤转移过程中的重要驱动因素。

研究人员首先从高危原发性黑色素瘤中最大的辅助研究——AVAST-M临床试验中获得数据以确定影响转移的转录变化【1-3】。通过对发生或未发生转移的样本进行差异表达分析拟确定61个可预测远处转移的转录物,且这些基因富集于细胞凋亡信号、谷氨酸受体和p53等信号通路。需要注意的是,与转移相关的转录变化既可以发生在转移前,也可以在转移后发生,因此需要一个可扩展的模型系统能从头观察这些基因的变化情况。为此,利用成年斑马鱼转基因电穿孔(TEAZ)和CRISPR-Cas9 构建了一个人类常见的由BRAFV600E和肿瘤抑制因子tp53和pten缺失所驱动的转移性黑色素瘤模型【4】。从ZFIN网址检索AVAST-M候选基因所对应的斑马鱼直系同源物,并将每个基因的sgRNA克隆到载体中,利用所搭建的平台对这些基因进行TEAZ筛选。作者发现,gramd1b的缺失导致TEAZ后4周和8周时原发性肿瘤面积增加,12周内脏转移增加。
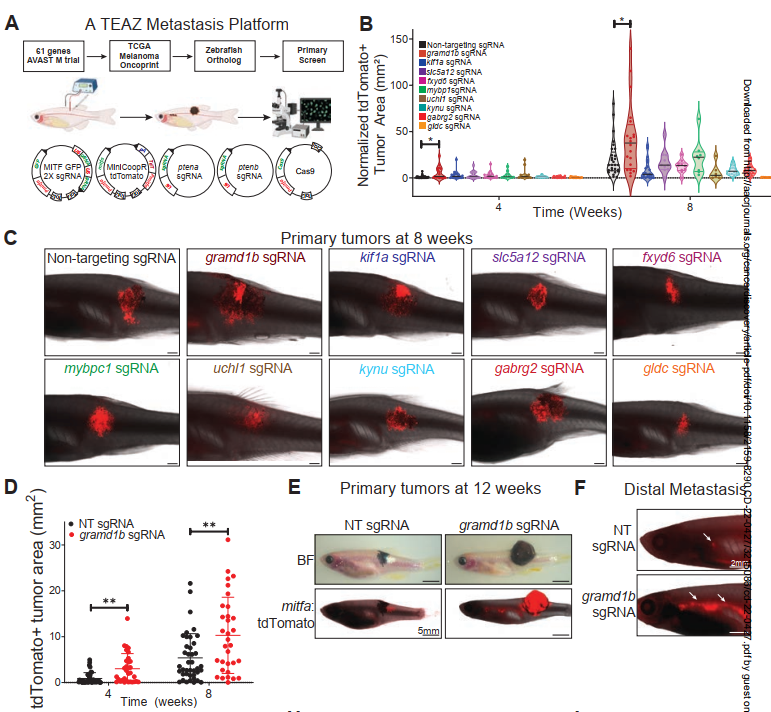
图1. 体内筛选确定GRAMD1B为黑色素瘤转移抑制因子
由于gramd1b缺失对斑马鱼黑色素瘤细胞的转移具有显着影响,作者试图研究其在人类黑色素瘤中的作用。对AVAST-M黑色素瘤队列样本的分析表明,具有低GRAMD1B表达的患者在AVAST-M黑色素瘤队列中的总体和无进展生存期较差,在另外三个独立的队列中也验证了这一点。为了更好地了解其在黑色素瘤中的作用,作者利用shRNA在人类SKMEL2细胞中敲低GRAMD1B,通过HE 染色进行的组织学检查证实了肝脏和肺中存在转移性结节。GRAMD1B作为胆固醇转运蛋白,介导胆固醇从质膜到内质网的非囊泡转移【5】。利用内源性胆固醇探针Filipin染色发现GRAMD1B敲低细胞中染色显着增加,提示游离胆固醇的积累。
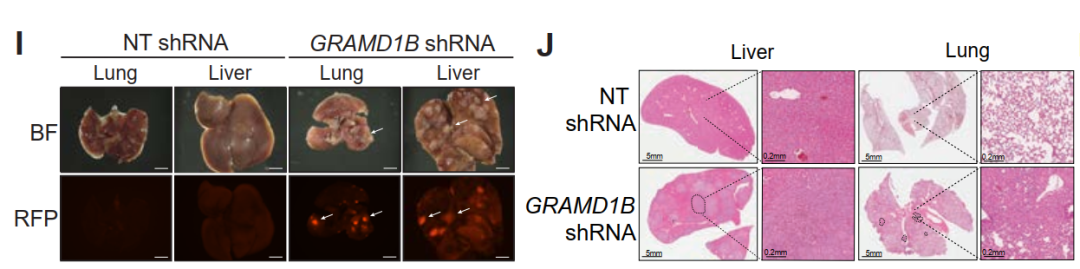
图2. GRAMD1B敲低可引起黑色素瘤的远端器官转移
由于GRAMD1B缺失导致游离细胞内胆固醇增加,作者假设GRAMD1B KO细胞的侵袭性取决于胆固醇积累。为了证明这一点。作者利用辛伐他汀耗尽胆固醇,发现与对照细胞相比,GRAMD1B shRNA细胞的侵袭性明显增加。已知游离胆固醇可以代谢成氧甾醇27-羟基胆固醇(27-HC),且这一物质已被证明是乳腺癌转移的驱动因素【6】。为了证明27-HC的作用,作者敲低了对照细胞和GRAMD1B shRNA细胞中合成27-HC的关键酶,这一处理可以明显降低GRAMD1B shRNA细胞的侵袭性。作者进一步对上述两种细胞进行了HOMER以推断哪些转录因子正在驱动基因表达的变化,发现GRAMD1B消耗导致AP-1基因的有效激活。最后,作者基于之前的报道利用JNK和ERK途径的化学抑制剂【7】处理上述两种细胞并证明了GRAMD1B KO细胞中的游离甾醇通过激活ERK信号传导以促进AP-1介导的侵袭程序和黑色素瘤细胞中的转移。
总之,这项工作证明AP-1轴的激活是GRAMD1B 缺失促进黑色素瘤转移一种机制,强调了预测肿瘤转移以及如何针对这些高风险病变进行治疗靶向的重要性,此外,还表明细胞内胆固醇运输失调可能是一个重要考虑因素,调节27-HC合成的机制可能是预防转移和复发的一种有效策略。
原文链接:
https://aacrjournals.org/cancerdiscovery/article/doi/10.1158/2159-8290.CD-22-0427/709861/Identifying-the-transcriptional-drivers-of?searchresult=1
参考文献
1. Corrie PG, Marshall A, Dunn JA, Middleton MR, Nathan PD, Gore M, et al. Adjuvant bevacizumab in patients with melanoma at high risk of recurrence (AVAST-M): preplanned interim results from a multicentre, open-label, randomised controlled phase 3 study. Lancet Oncol. 2014 May;15(6):620–30.
2. Garg M, Couturier D-L, Nsengimana J, Fonseca NA, Wongchenko M, Yan Y, et al. Tumour gene expression signature in primary melanoma predicts long-term outcomes. Nat Commun. 2021 Feb 18;12(1):1137.
3. Corrie PG, Marshall A, Nathan PD, Lorigan P, Gore M, Tahir S, et al. Adjuvant bevacizumab for melanoma patients at high risk of recurrence: survival analysis of the AVAST-M trial. Ann Oncol. 2018 Aug 1;29(8):1843–52.
4. Dankort D, Curley DP, Cartlidge RA, Nelson B, Karnezis AN, Damsky WE, et al. Braf(V600E) cooperates with Pten loss to induce metastatic melanoma. Nat Genet. 2009 May;41(5):544–52.
5. Sandhu J, Li S, Fairall L, Pfisterer SG, Gurnett JE, Xiao X, et al. Aster proteins facilitate nonvesicular plasma membrane to ER cholesterol transport in mammalian cells. Cell. 2018 Oct 4;175(2):514-529.e20.
6. Baek AE, Yu Y-RA, He S, Wardell SE, Chang C-Y, Kwon S, et al. The cholesterol metabolite 27 hydroxycholesterol facilitates breast cancer metastasis through its actions on immune cells. Nat Commun. 2017 Oct 11;8(1):864.
7. Eferl R, Wagner EF. AP-1: a double-edged sword in tumorigenesis. Nat Rev Cancer. 2003 Nov;3(11):859–68.


想了解更多精彩内容,快来关注BioArt生物艺术
| 留言与评论(共有 0 条评论) “” |