*仅供医学专业人士阅读参考
王晓稼教授带你探索ADC在HER2低表达领域治疗机会
约40%-50%的乳腺癌患者处于HER2低水平表达状态,但以往经典的抗HER2靶向药物在HER2低表达领域“表现欠佳”。
抗体-药物偶联物(ADC)兼具了传统化疗的强大杀伤力和抗体药物的肿瘤靶向性,近20余年来在乳腺癌领域发展迅速。
日前,第25届全国临床肿瘤学大会暨2022年CSCO乳腺癌专家委员会内分泌专场圆满落幕。会上王晓稼教授进行了题为《抗体-药物偶联物(ADC)在HER2低表达领域治疗机会》的报告,为各位学者总结了当前ADC药物的迅速发展对临床治疗产生的巨大影响。医学界特为此内容作出报道。

王晓稼教授在CSCO大会上发表报告
ADC药物的起源与发展
ADC的概念最早于100多年前提出,2000年时首个ADC药物曲妥珠单抗获批上市,后经历了长达10余年的探索阶段。到2013年,T-DM1获批用于治疗HER2阳性转移性乳腺癌,自此ADC药物迅速发展,不断更新迭代,如今新一代靶向ADC药物强势崛起,引领靶向抗癌领域进入了新时代。
新一代靶向ADC药物的“强旁观者效应”、“直接杀伤HER2 1+和2+细胞”以及“稳定精准的靶性递送”三重特点,使其具有强效的抗肿瘤作用。
目前ADC是抗肿瘤药物研发非常重要的领域,相继已有多款新药研发上市,如国内的抗HER2治疗药物RC48(维迪西妥单抗)、A166,抗Trop2治疗药物BAT8003等,国外一鸣惊人的靶向HER2治疗药物T-DXd、靶向Trop-2的ADC药物戈沙妥珠单抗(SG)等。
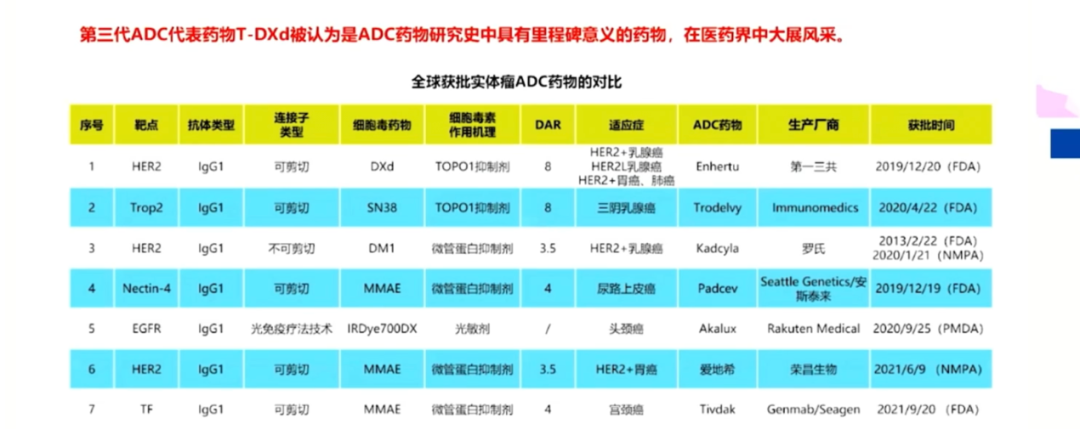
全球获批实体瘤ADC药物对比-截图来自王晓稼教授报告
既往多项研究在HER2低表达乳腺癌领域频频失利,新型ADC药物的出现在多个癌种领域展现了巨大的临床价值,王晓稼教授特别介绍了DESTINY-Breast系列试验在HER2低表达乳腺癌领域迄今取得的优异成果。
ADC“明星”药物T-DXd研究里程碑
▌DESTINY-Breast 01:T-DXd初露锋芒
DESTINY-Breast 01研究中纳入HER2+不可切除或转移性乳腺癌且既往接受过T-DM1治疗的成年患者,研究结果显示,在既往中位治疗为6线,184例接受推荐剂量(5.4mg/kg)治疗的患者中,客观缓解率(ORR)为60.9%,中位无进展生存期(PFS)达16.4个月,中位持续缓解时间(DOR)达14.8个月。
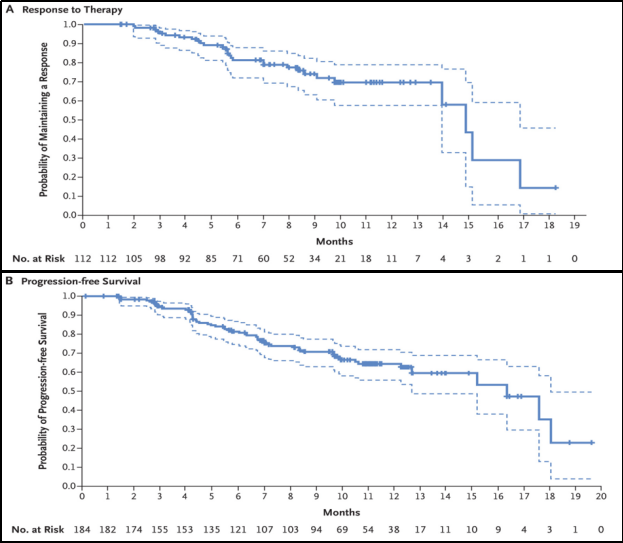
DESTINY-Breast 01研究ORR、PFS数据
▌DESTINY-Breast 03:树立晚期乳腺癌治疗新标准
DESTINY-Breast 03研究中纳入HER2+不可切除或转移性乳腺癌患者,按1:1比例随机分配接受T-DXd或T-DM1治疗,研究结果显示T-DXd组的ORR较T-DM1组高出一倍多(79.7%vs 34.2%),较T-DM1组的PFS也有显著改善(NR vs 6.8个月;HR 0.28;95%CI 0.22-0.37;P<0.001)。T-DXd由此获得美国国家综合癌症网络(NCCN)、美国临床肿瘤学会(ASCO)、欧洲肿瘤内科学会(ESMO)等权威指南推荐。
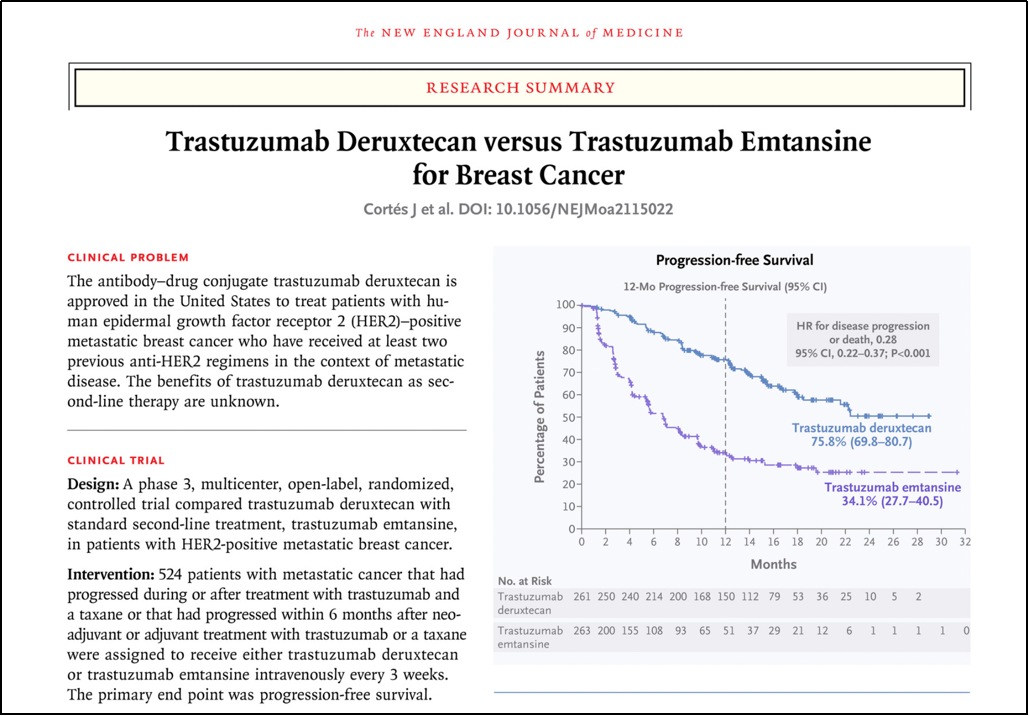
DESTINY-Breast 03研究
▌DESTINY-Breast 04:打破HER2阴阳二分格局
DESTINY-Breast 04研究中纳入既往接受过一线或二线化疗的HER2低表达(定义为IHC 1+/IHC 2+且ISH阴性)的不可切除或转移性乳腺癌患者,以2:1的比例随机分配接受T-DXd治疗或医生选择的化疗(TPC,仅限于卡培他滨、艾立布林、吉西他滨、紫杉醇和白蛋白紫杉醇)。研究结果显示,在HR+患者中,T-DXd组中位PFS为10.1个月(95%CI 9.5-11.5),而TPC组为5.4个月(95%CI 4.4-7.1)(HR 0.51;95%CI 0.40-0.64;P<0.001),OS分别为23.9个月vs 17.5个月(HR 0.64;95%CI 0.48-0.86;P=0.003)。

DESTINY-Breast 04研究PFS、OS、ORR
DESTINY-Breast 04研究的震撼发布推动了2022年NCCN和ASCO指南的快速更新:
针对HER2低表达的不可切除或转移性乳腺癌患者,既往在转移性疾病阶段接受过至少一次化疗,如激素受体阳性(HR+)则为内分泌难治性,应给予T-DXd治疗。
T-DXd的出现标志着HER2低表达乳腺癌患者的治疗格局将被改写。
此外,2022年8月5日,美国食品药品监督管理局(FDA)基于DESTINY-Breast 04批准T-DXd用于无法切除或转移的HER2低表达乳腺癌患者。
这是临床上首个针对HER2低表达患者的治疗药物,为乳腺癌患者的生存改善提供了更多可能,对乳腺癌治疗领域意义非凡。
HER2低表达晚期乳腺癌的治疗变革
2022版CSCO乳腺癌指南将HER2低表达定义为IHC 1+/IHC 2+且ISH阴性。T-DXd出现前的较长一段时间里,HER2低表达患者处于一种“无药可用”的状态,大多被归为HER2阴性亚型中进行内分泌治疗或化疗。
王晓稼教授提到,既往多项研究表明,传统的靶向治疗(如曲妥珠单抗、帕妥珠单抗、T-DM1等)在HER2低表达领域效果不理想,且HER2表达水平和预后之间没有明显的相关性,即HER2低表达对临床预后的预测能力一般,尚不能作为分子分型的重要参数。
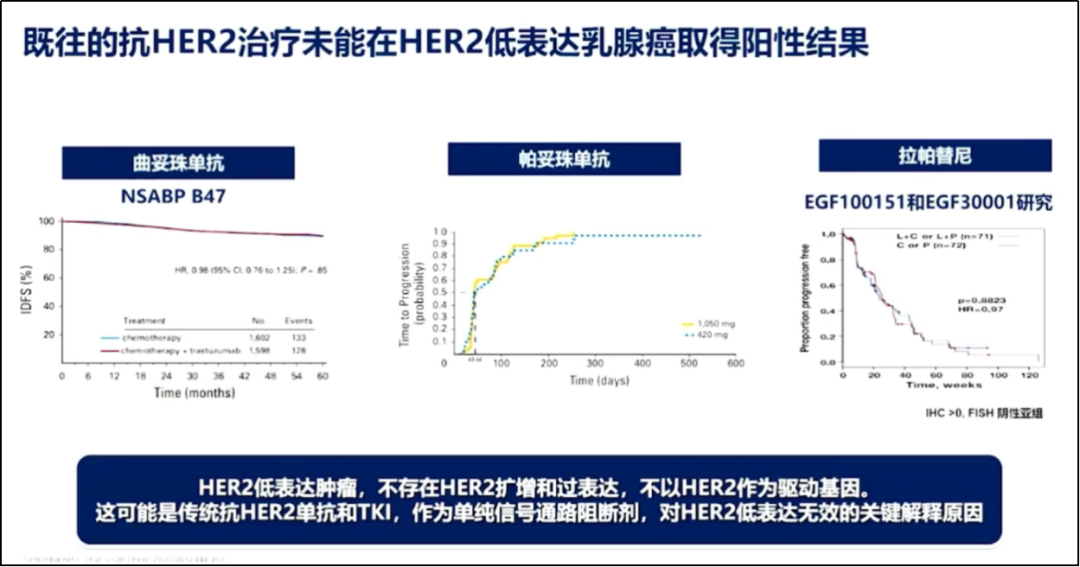
既往抗HER2治疗的疗效
王晓稼教授谈到,HER2低表达的患者长期以来对安全、有效的治疗有着大量未被满足的需求,随着越来越多新型ADC药物的开发研制,我们有理由相信在不远的未来,HER2低表达的乳腺癌患者也将从精准的靶向治疗中获益。
王晓稼教授补充道,目前CDK4/6i治疗失败的领域里I级治疗仍是空白的推荐,T-DXd用于CDK4/6经治的HR+/HER2-晚期乳腺癌患者中表现优异,有望在明年写入指南,填补CDK4/6i经治分层的空白。

截图来自王晓稼教授报告
ADC药物在其他领域布局
T-DXd作为新一代ADC药物的佼佼者,除了乳腺癌领域,在其他实体瘤HER2低表达领域的研究也收获颇丰。如2020年ESMO年会报道了DESTINY-Gastric01研究中HER2低表达探索性队列的相关结果。
■ DESTINY-Gastric01:展现T-DXd治疗HER2低表达胃癌的初步疗效
DESTINY-Gastric01是一项随机、开放标签、多中心、II期临床试验,主要目的在于对比T-DXd和化疗两种方案治疗HER2阳性转移性胃癌的疗效,同时在探索性队列中探讨了T-DXd对HER2低表达人群的临床获益情况。
研究结果表明,在探索队列中,队列1(HER2 IHC2+/ISH-)患者19例,队列2(HER2 IHC1+)患者21例。队列1的ORR达36.8%,中位DOR 7.6个月,中位OS 7.8个月,中位PFS 4.4个月;队列2 ORR达19%,中位DOR 12.5个月,中位OS 8.5个月,中位PFS 2.8个月。显示出T-DXd在HER2低表达的晚期胃癌或胃食管交界处(GEJ)癌患者中,具有的良好抗肿瘤效果。
SG研究进展介绍
除上述提到的ADC界“明星”药物T-DXd外,戈沙妥珠单抗(SG)在HER2低表达领域也占有一席之地。2022年ESMO大会对SG在TROPICS-02研究中HER2低表达亚组的分析结果进行了报道。
SG是一款首创靶向TROP2的ADC药物,TROP2在大约80%的乳腺癌中高表达,无论何种亚型。2022年6月7日SG被FDA批准用于既往接受过2中系统治疗(至少1种治疗针对转移病变)的不可切除或转移的三阴性乳腺癌(TNBC)患者。
■ TROPICS-02:走在TROP-2靶向ADC药物的前沿
TROPICS-02是一项全球多中心、随机、放标签、III期临床试验,主要目的旨在评估SG在接受过内分泌治疗、CDK4/6抑制剂以及2~4线化疗的TNBC患者的临床疗效和安全性。
研究结果显示,在HER2低表达亚组,SG组的中位PFS优于TPC组(6.4个月vs 4.2个月;HR 0.58;95%CI 0.42-0.79;P<0.001),与意向治疗人群(ITT)一致;OS分别为26%vs 12%(OR 2.52;95%CI 1.33-4.78),临床获益率(CBR):38%比19%(OR 2.50;95%CI 1.46-4.30),中位缓解持续时间(DOR)为7.4个月vs 4.1个月。

TROPICS-02研究方案
此该研究结果表明,SG不但可以改善TNBC患者的临床结局,而且在HER2低表达人群中具有一致获益。即SG的疗效不受HER2表达状态(HER2-Low或HR+/HER 2 IHC0)的影响。但需注意的是,ESMO大会上也随即也有专家对此结论提出异议,认为关于SG在HER2低表达人群中的获益情况尚待进一步研究证实。
王晓稼教授表示,随着ADC药物的兴起,HER低表达/HR+晚期乳腺癌不再处于一种束手无策的局面,尽管当前国内药物可及性不如人意,但相信未来一定前景广阔。
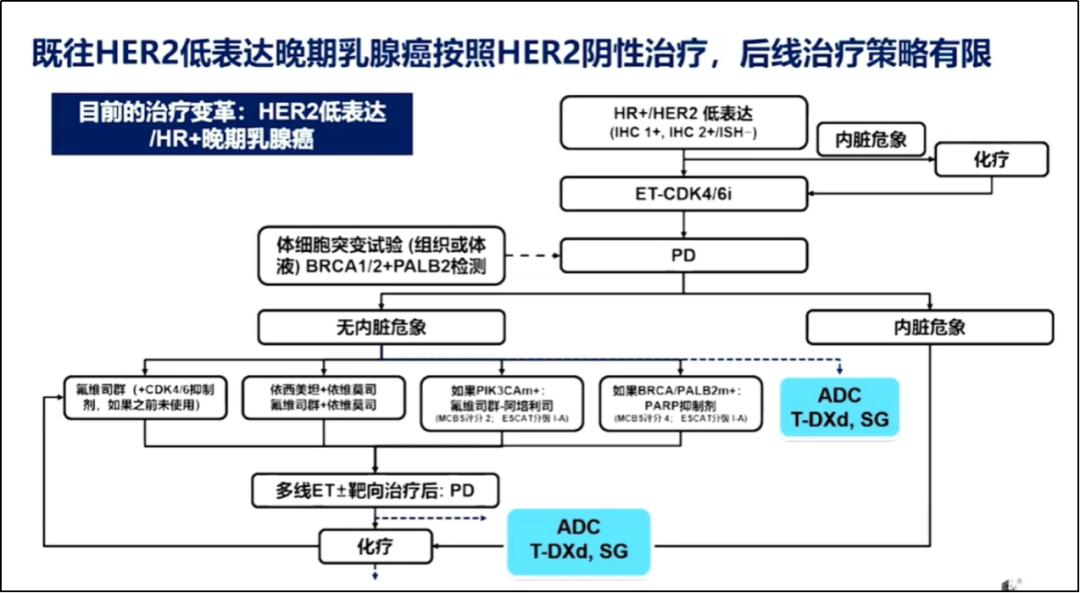
ADC药物出现后HR+/HER2低表达晚期乳腺癌的治疗策略
ADC药物在HER2低表达乳腺癌中的未来探索
王晓稼教授强调,ADC药物在HER2低表达领域的潜力巨大,但现今仍面临诸多挑战。如HER2低表达的下限尚不明确,且HER2表达极具异质性,其状态也可能随着治疗而发生改变,如何准确识别HER2低表达人群对于临床研究及实践的开展至关重要。随后介绍了DESTINY-Breast 06和DESTINY-Breast 08两项极具前景的研究。
■ DESTINY-Breast 06:继续进军,未来可期
DESTINY-Breast 06研究是一项聚焦于HER2低表达乳腺癌的III期临床试验,在DESTINY-Breast 04基础上更进一步。研究纳入HER2低表达和超低表达(0<IHC<1+)的不可切除或转移性乳腺癌患者,随机接受T-DXd或TPC一线化疗。主要终点为独立评估的PFS,次要终点有OS、ORR、DOR等。
该研究将目标人群拓展至HER2超低表达人群,其成果将有助于识别T-DXd的适用范围,或将推进T-DXd的治疗线序。

截图来自王晓稼教授报告
■ DESTINY-Breast 08:探索研究T-DXd联合治疗HER2低表达乳腺癌
DESTINY-Breast 08研究分为T-DXd+卡培他滨、T-DXd+度伐利尤单抗+紫杉醇、T-DXd+capivasertib、T-DXd+阿那曲唑、T-DXd+氟维司群共5个模块,旨在探索性研究T-DXd与其他抗癌药物联合使用治疗转移性HER2低表达乳腺癌患者的安全性、耐受性、药代动力学及肿瘤活性。
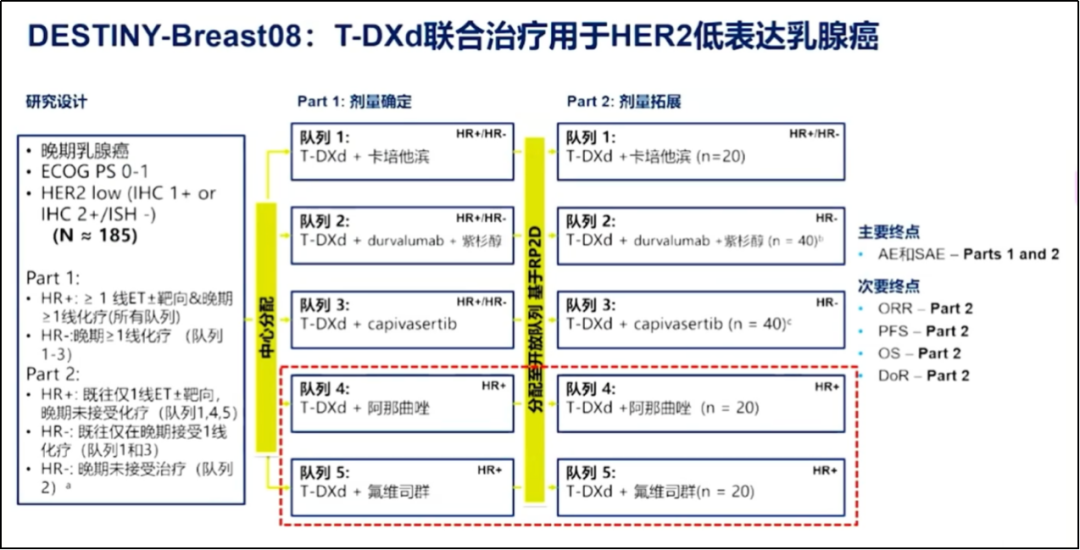
截图来自王晓稼教授报告
王晓稼教授在演讲的最后表示,ADC药物治疗HER2低表达乳腺癌仍处于探索当中,T-DXd的出现对我们的传统治疗产生了巨大影响。除了T-DXd外,还有RC-48、SYD985、MRG002等ADC药物都进入到了积极的临床试验阶段,非常期待这样的研究能为临床患者带来福音,挑战现有的标准治疗方案,进一步改变临床实践!
专家简介

王晓稼 教授
博士、主任医师(二级)
博士生及博士后导师
中国科学院大学附属肿瘤医院/浙江省肿瘤医院院长助理、乳腺内科主任
国家重点研发计划创新合作重点专项首席专家
浙江省肿瘤智能诊断和分子技术研究中心副主任
中国临床肿瘤学会(CSCO)乳腺癌专家委员会副主任委员
中国抗癌协会乳腺癌专业委员会常委、医学伦理委员会常委
浙江省乳腺癌质控专家委员会主任委员
浙江省医学会肿瘤内科分会主任委员、疼痛分会副主委
浙江省抗癌协会乳腺癌专业委员会主任委员、肿瘤内科专委会前任主委
浙江省免疫学会副理事长(肿瘤免疫与生物治疗专业委员会前任主委)
浙江省转化医学学会副会长兼精准医学分会会长
本文首发:医学界肿瘤频道
本文作者:苏旭晗
责任编辑:Sweet
| 留言与评论(共有 0 条评论) “” |