
撰文 | Qi
免疫刺激性细胞因子具有作为免疫治疗剂的巨大潜力,但其临床应用也受到全身免疫激活引起的严重毒性的限制。目前已经开发细胞因子与单克隆抗体或抗体片段的融合物,但受限于细胞因子受体的广泛分布,因而也开发了一些在肿瘤部位特异性激活细胞因子的方法【1-3】。IL-2是一种多效性细胞因子,被批准用于治疗黑色素瘤和肾细胞癌,但其治疗潜力受到CD25+细胞的优先激活和与全身性IL-2活性相关的严重剂量限制毒性的限制。与大多数天然蛋白质一样,IL-2具有结构不规则性,会转化为非理想的生化特性。从头设计的IL-2模拟物Neoleukin-2/15 (Neo-2/15) 通过激活IL-2Rβ和IL-2Rγ再现IL-2和IL-15的免疫刺激功能【4-6】。与天然IL-2相比,这种模拟物通过避免优先激活CD25+免疫细胞以诱导有效的免疫治疗效果,同时降低毒性。然而,如果没有额外的定位策略,由于免疫细胞的靶向、非肿瘤激活导致的全身过度激活仍可能导致高剂量毒性。

2022年10月31日,来自华盛顿大学的David Baker团队等多个团队在Nature Biotechnology杂志上合作发表了一篇题为 A split, conditionally active mimetic of IL-2 reduces the toxicity of systemic cytokine therapy 的文章,利用改造的IL-2模拟物Neo-2/15:既可用于反式激活靶向肿瘤细胞周围的免疫细胞,也用于顺式激活直接靶向的免疫细胞。在反式激活模式下,与小鼠黑色素瘤模型中的全身治疗相比,两种成分的肿瘤抗原靶向增强了抗肿瘤活性并减弱了毒性。在顺式激活模式下,两种成分的免疫细胞靶向在小鼠黑色素瘤模型中选择性扩增CD8+ T 细胞,并在淋巴瘤异种移植模型中促进嵌合抗原受体 T 细胞活化,增强两种情况下的抗肿瘤功效。

在Neo-2/15蛋白中,螺旋H3与IL-2Rβ相互作用,H4与IL-2Rγ相互作用,H1与两种受体相互作用。作者旨在将这些螺旋中的一个与其他螺旋分开,以便受体异二聚化只能在两个片段都存在的情况下实现。作者为Neo-2/15测试了三对拆分版本:①H1和H3–H2'–H4;②H1–H3和H2'–H4;以及③H1–H3–H2'和H4。在所有三种情况下,当两个片段组合时观察到比单独的任何一个片段都要强得多的IL-2受体结合和信号传导,对于分裂对①H1和H3-2'-4,即使在高浓度下,单独的片段也没有表现出任何活性,因而选择这对进行后续研究,分别称为Neo2A和Neo2B。在不存在IL-2受体亚基的情况下,这两个分裂片段彼此具有低亲和力,但在可溶性IL-2Rβ和IL-2Rγ存在时形成更高亲和力的复合物。
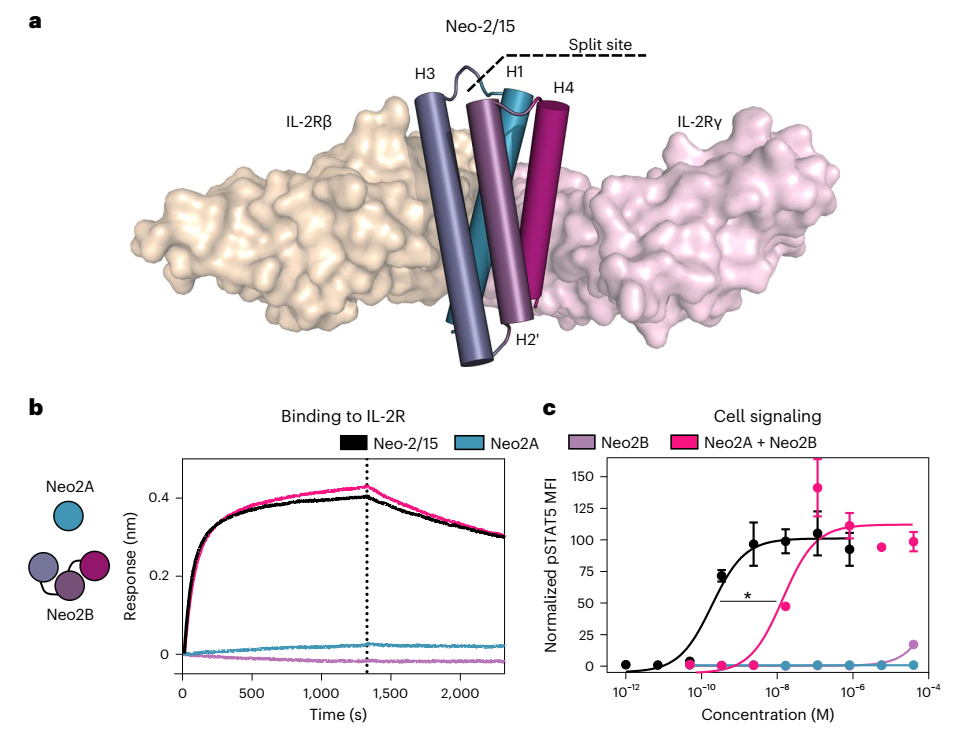
图1. Neo-2/15可以分裂成两个片段,当结合时可以重新组成其活性。
为了评估靶向分裂Neo-2/15蛋白在与靶向肿瘤细胞结合时是否能够反式激活免疫细胞,作者在存在对IL-2反应的NK细胞系YT-1的条件下,将Neo2A和Neo2B分裂片段靶向双阳性HER2+/EGFR+ K562细胞系,并将STAT5磷酸化作为IL-2信号传导的读数。作者观察到靶向Neo2A-Neo2B对的选择性激活,但需要肿瘤细胞与免疫细胞的高比率(20:1)。紧接着,作者将每个分裂的Neo-2/15片段与αPD-L1纳米抗体B3融合,并将它们靶向表达PD-L1的B16F10黑色素瘤细胞。肿瘤细胞是在αCD28抗体存在下与黑色素瘤抗原特异性αTrp-1CD8+ T 细胞共培养过夜以提供共刺激,结果显示靶向B16细胞表面的分裂Neo-2/15片段有效地反式激活抗原特异性T 细胞。
接下来,作者评估分裂的Neo-2/15 的安全性和治疗活性。在合适的剂量下,相较于完整的Neo-2/15融合蛋白来说,未在小鼠中发现任何毒性迹象,并且能引起黑色素瘤小鼠的生存期延长和肿瘤完全清除,以及外周血中CD8+ T 细胞扩增和激活。
上述结果说明分裂Neo-2/15用于靶向实体瘤以局部扩大免疫细胞群的潜力。一些免疫治疗策略受益于细胞因子介导的特定免疫细胞亚型的系统性扩增,以促进抗肿瘤作用(顺式激活),例如增强过继细胞中预先存在的细胞毒性CD8+T 细胞或CAR-T细胞的治疗应用。为了特异性靶向CD8+ 细胞毒性T 细胞,作者将分裂的Neo-2/15蛋白与ɑCD8纳米体靶向结构域融合,在健康Foxp3-GFP小鼠中给予ɑCD8分裂Neo-2/15、ɑCD8完整Neo-2/15和非靶向对照,用靶向分裂Neo2/15治疗的人群诱导更大的CD8+ T 细胞特异性增殖。类似的,作者设计了CAR-T细胞以共表达截短的HER2,用作上述分裂Neo-2/15 αHER2融合蛋白的靶标。表达表面HER2的CAR-T细胞在顺式靶向分裂Neo-2/15存在的条件下可以引发有效的肿瘤杀伤。这些顺式激活研究说明了这种靶向条件激活方法在癌症免疫治疗中的潜力。
总之,分裂Neo-2/15系统的开发解决了当前与 IL-2 治疗相关的两个主要工程挑战,即CD25偏向性和引发的全身免疫激活,并在临床前模型中发挥强大功能并降低全身毒性。这种方法为新应用打开了大门,可以通过从头设计来开发高度特异性的、可以被条件性激活的治疗性蛋白质。
原文链接:
https://doi.org/10.1038/s41587-022-01510-z
参考文献
1. Garcin, G. et al. High efficiency cell-specific targeting of cytokine activity. Nat. Commun.5, 3016 (2014).
2. Salmeron, A. et al. Abstract 1723: WTX-124 is an IL-2 pro-drug conditionally activated in tumors and able to induce complete regressions in mouse tumor models. Cancer Res.81, 1723 (2021).
3. Venetz, D., Koovely, D., Weder, B. & Neri, D. Targeted reconstitution of cytokine activity upon antigen binding using split cytokine antibody fusion proteins. J. Biol. Chem. 291, 18139–18147 (2016).
4. Silva, D.-A. et al. De novo design of potent and selective mimics of IL-2 and IL-15. Nature565, 186–191 (2019).
5. Levin, A. M. et al. Exploiting a natural conformational switch to engineer an interleukin-2 ‘superkine’. Nature 484, 529–533 (2012).
6. Charych, D. H. et al. NKTR-214, an engineered cytokine with biased IL2 receptor binding, increased tumor exposure, and marked efficacy in mouse tumor models. Clin. Cancer Res.22, 680–690 (2016).


想了解更多精彩内容,快来关注BioArt生物艺术
| 留言与评论(共有 0 条评论) “” |