*仅供医学专业人士阅读参考
HERB研究揭示新型ADC药物在胆道癌(BTC)中的治疗潜力。
晚期胆道癌的预后较差,现有一线治疗耐药后的治疗获益常常不尽人意,针对特定突变的靶向治疗是否可以带来更大的获益?2022年ASCO大会上公布了抗HER2明星药物DS-8201用于BTC晚期后线治疗的HERB试验[1]结果,探索了晚期BTC治疗的全新可能。针对该项研究,ADC Academy Online有幸邀请北京大学肿瘤医院周军教授对其进行深入解读。
前情提要
BTC是包括胆管癌(包括发生于肝内、肝门周围、以及远端的胆管癌)、胆囊癌以及壶腹癌(AVC)在内的一系列侵袭性腺癌的统称,在大多数高收入国家是低发病率的恶性肿瘤,但近三十年来呈现逐年上升的趋势。中国相对于西方发达国家的发病率明显更高[2],有证据提示,胆结石、乙肝、以及代谢性疾病(如糖尿病等)的患者罹患胆道癌的几率更高[3-5]。
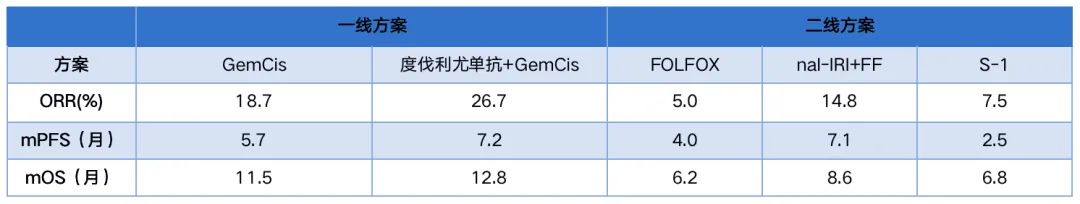
对于BTC,手术是治愈的基石。然而,大多数BTC患者在确诊时疾病已进展到局部晚期或已发生转移(以下统称为晚期BTC),患者预后极差。以胆管癌为例,无论发生在肝内或肝外,转移性疾病的5年生存率均仅为2%。转移性BTC的标准治疗方案是以化疗为代表的系统治疗[6],吉西他滨联合顺铂(GemCis)方案是晚期BTC患者一线治疗的优选方案,此外,2022 NCCN指南基于III期TOPAZ-1试验中度伐利尤单抗联合GemCis相对于单纯GemCis方案可以带来中位总生存期(mOS)的显著获益(mOS:度伐利尤单抗+GemCis 12.8个月vs安慰剂+GemCis 11.5个月,HR 0.8,95%CI 0.66-0.97,p=0.021),新增度伐利尤单抗联合GemCis同样作为一线治疗推荐方案[7]。目前二线治疗的标准方案是FOLFOX(叶酸,氟尿嘧啶和奥沙利铂)方案,患者的中位OS为6.2个月,客观缓解率(ORR)仅为5%。
表1.晚期BTC患者系统治疗方案及获益[1]
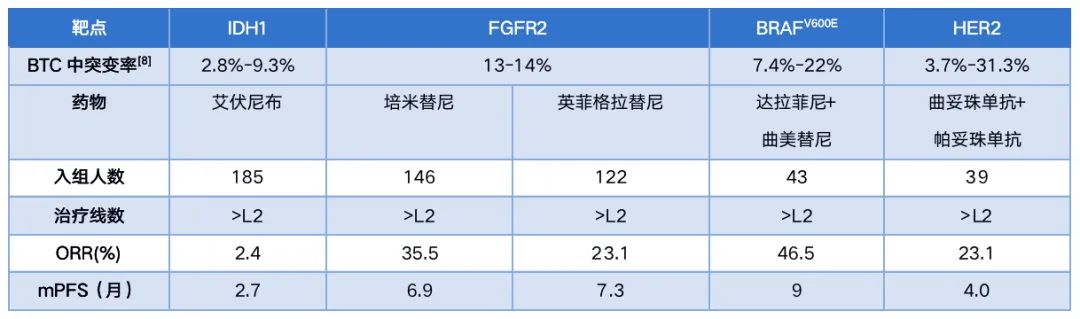
尽管指南对晚期BTC患者进行了如上的推荐,标准治疗的获益仍然无法令人满意。因此,对于存在特定基因突变的患者,指南推荐可在后线进行靶向治疗以进一步提高患者的获益,例如对于存在FGFR2融合或重排的胆管癌患者可以选择佩米替尼或英菲格拉替尼;存在IDH1突变的胆管癌患者可以选择艾伏尼布;其他还包括针对BRAF、HER2等分子靶点的研究探索,但是相关研究均为后线治疗探索,且患者群体较少。总体而言,新型靶向治疗在晚期BTC患者中的应用仍需要更多的探索,其中,HER2变异在晚期BTC相对常见,且临床使用经验较为成熟,因此抗HER2的靶向治疗在晚期BTC的系统治疗中被临床医生给予了厚望。
表2.晚期BTC的一些特定突变可选方案及其临床获益[1]
HER2是由ERBB2基因编码的表皮生长因子受体(EGFR)酪氨酸激酶家族的重要成员,在包括胃癌、非小细胞肺癌、结直肠癌、膀胱癌等多种癌症中均存在表达,且在细胞增殖中起着关键作用。HER2变异包括基因突变、基因扩增和蛋白质过表达等,既往研究数据显示HER2靶向治疗可用于存在HER2变异的晚期乳腺癌和胃癌患者。HER2变异在BTC患者中同样观察到,存在于约31.3%的胆囊癌、3%-18.5%的肝外胆管癌、16.4%的壶腹癌以及3.7%的肝内胆管癌中[1],且既往研究提示HER2过表达细胞株显示出增强的侵袭性、运动性和增殖性[9]。因此,可以推测HER2变异与部分BTC患者的发病和预后存在相关性,抗HER2治疗可能对存在HER2变异的BTC患者有效[10-14]。
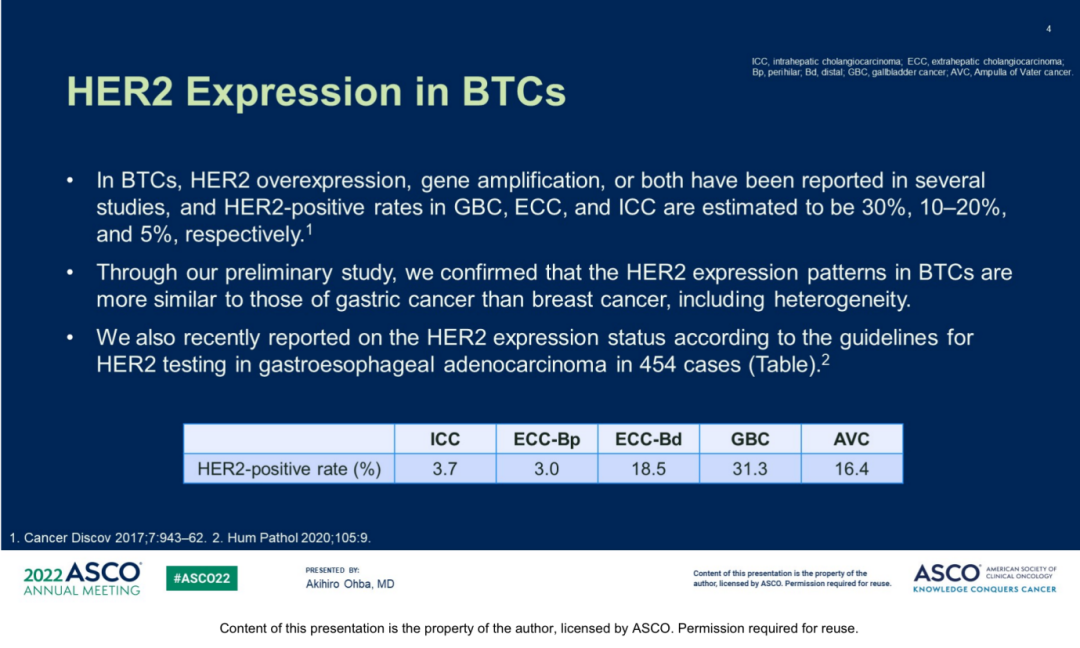
图1.BTC患者HER2的表达率
研究介绍
HERB试验(NCCH1805,JMA-IIA00423)是一项由研究者发起的多中心、单臂试验,旨在评估DS-8201用于治疗既往吉西他滨为基础的化疗后进展或不可耐受的不可切除或复发的HER2阳性*或低表达**的BTC患者的有效性和安全性。
*HER2阳性:免疫组化(IHC)3+,或IHC 2+但荧光原位杂交(FISH)阳性(HER2/CEP17比值≥2.0);
**HER2低表达:IHC/ISH 0/+、1+/-、1+/+或2+/-。
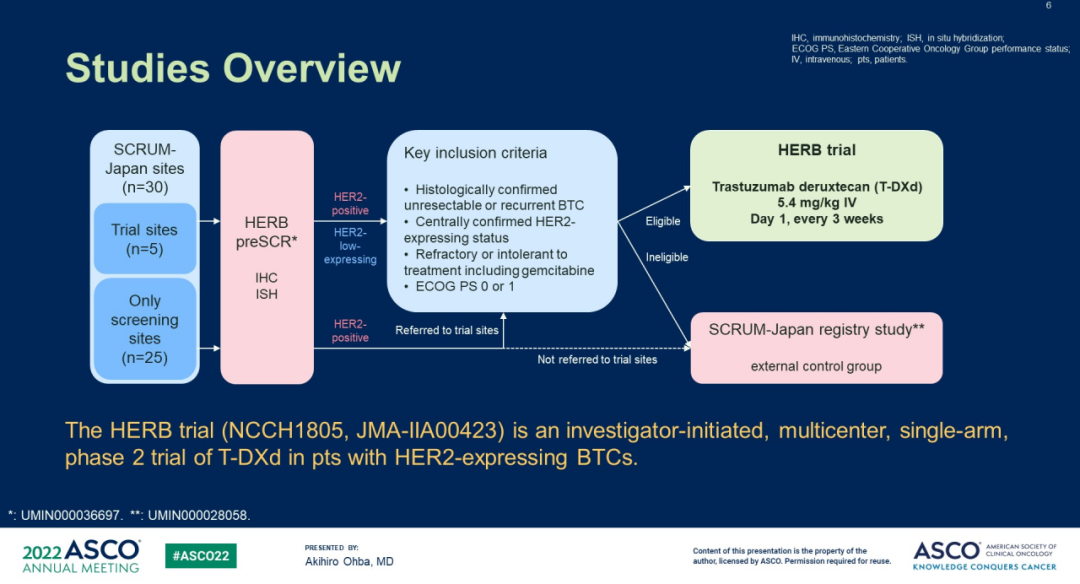
图2.HERB试验设计
HERB试验的主要研究终点是盲态独立中心审查委员会(BICR)评估的HER2阳性患者的确认的ORR;次要研究终点包括HER2阳性和HER2低表达患者中当地研究者审查(LIR)评估的ORR、疾病控制率(DCR)、无进展生存期(PFS)、OS,以及治疗相关不良事件(TEAE)的发生率。
今年的ASCO大会上公布了HERB试验的结果。截至2021年7月,研究共纳入30例晚期BTC患者:其中22例为HER2阳性,8例为HER2低表达;BTC原发肿瘤部位:胆囊癌43.3%(13例)、肝外胆管癌26.7%(8例)、肝内胆管癌20%(6例)、壶腹癌10%(3例);90%(27例)为转移性BTC,10%(3例)为局部进展性肿瘤,且70%(21例)既往接受过二线或以上的治疗。

图3.HERB试验纳入人群及基线特征
疗效数据显示,整体患者的ORR为30%(14.7-49.4),HER2阳性患者的ORR为36.4%(95%CI 19.6-56.1),HER2低表达患者的ORR为12.5%(0.3-52.7);整体患者的DCR为80%(61.4-92.3),其中HER2阳性患者为81.8%(59.7-94.8),HER2低表达患者也有75%(34.9-96.8);
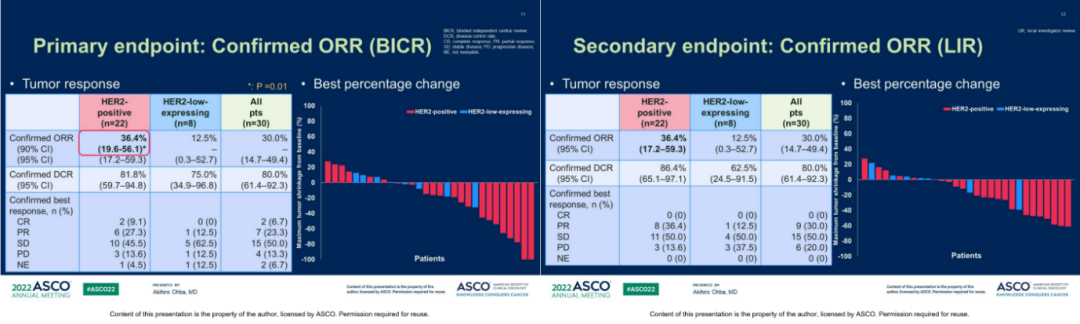
图4.BICR评估的确认的ORR(左)及LIR评估的ORR(右)
HER2阳性患者的中位PFS为5.1个月(3.0-7.3),HER2低表达患者为3.5个月(1.2-5.5);HER2阳性患者的中位OS为7.1个月(4.7-14.6),HER2低表达患者为8.9个月(3.0-12.8)。
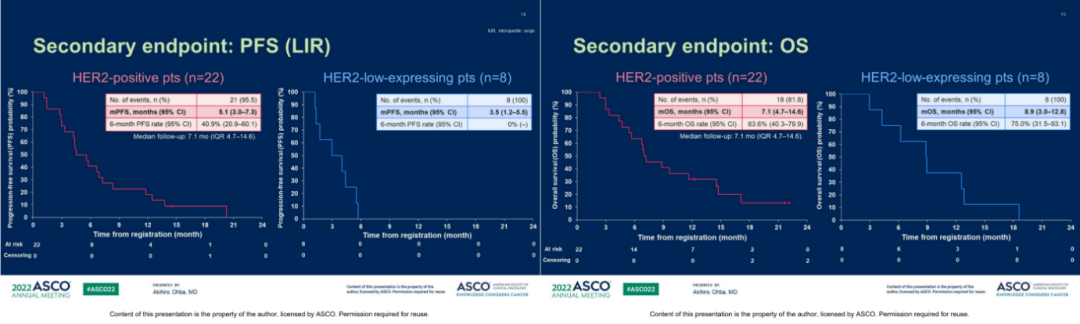
图5.PFS(左)和OS(右):DS-8201对于HER2阳性还是低表达患者均有获益
事后分析显示,HER2阳性患者的中位缓解持续时间为7.4个月(2.8-NA),其中有50%的患者获得了6个月以上的肿瘤缓解。
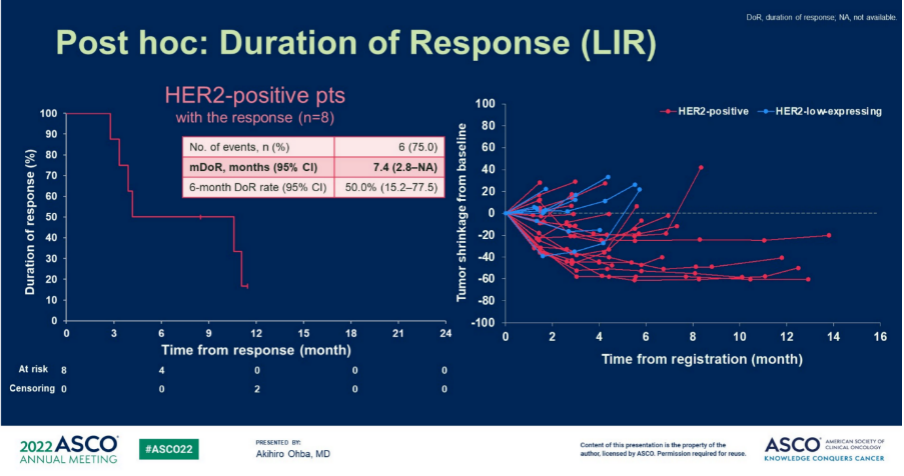
图6.事后分析:HER2阳性患者的中位缓解持续时间可长达7.4个月
在安全性方面,DS-8201的安全性数据与既往临床数据一致,并未观察到新的不良信号。整体最常见的不良事件包括1)血液系统毒性如贫血(68.8%,≥3级53.1%)、中性粒细胞计数减少(56.3%,≥3级31.3%)、血小板减少(43.8%,≥3级9.4%)等;2)胃肠道反应如恶心(43.8%,≥3级未发生)、厌食(37.5%,≥3级3.1%)、呕吐(21.9%,≥3级未发生);此外还有包括脱发(40.6%,≥3级未发生)以及间质性肺病(ILD)等;ILD是研究中特别关注的不良事件,研究中共有8例患者发生ILD,其中4例为1-2级,2例为3级,2例为5级,中位至ILD发生时间为自开始治疗的124天(35-247)。
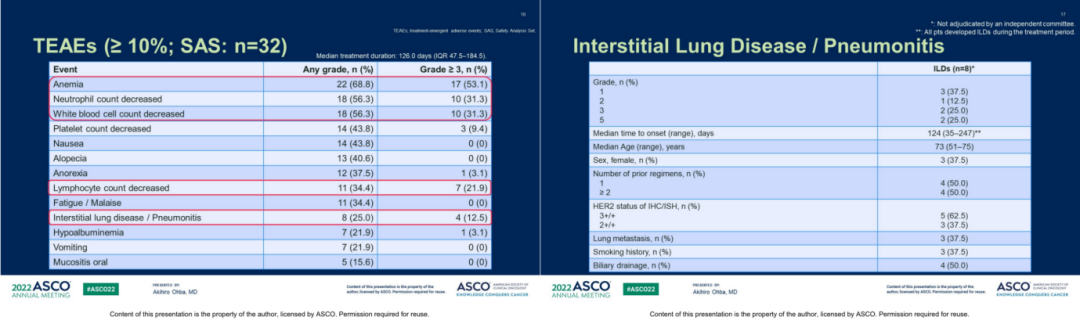
图7.HERB研究中整体TEAE(左)和ILD(右)的发生率
HERB研究显示了DS-8201在存在HER2表达的BTC患者中的疗效,其中HER2阳性BTC患者疗效尤为明显,HER2低表达患者也表现出了一些获益的证据,这为后续DS-8201在晚期BTC进一步的探索和使用奠定了基础。
文章点评
近年来在晚期BTC中,探索HER2变异与预后的关系以及靶向HER2的治疗逐渐进入临床医生的视野,现有的抗HER2治疗的探索包括针对HER2扩增和过表达,以及HER2突变。HER2过表达被认为是BTC不良预后的独立预测因素[16],而携带HER2突变或扩增的患者相对于其他患者可能有更差的预后[17],这些数据均提示了HER2变异的晚期BTC患者可能存在更大的治疗紧迫性。继既往临床探索证实了抗HER2的靶向治疗可以成为晚期BTC患者的靶点[18]。2021年一篇曲妥珠单抗生物类似物联合GemCis在晚期BTC中获得了50%的ORR及100%的DCR,相对于临床医生治疗选择有更好的PFS以及OS数据,进一步提示了靶向HER2有可能成为晚期BTC一个值得关注、并且可能带来更大治疗获益的新方向[19]。
HERB试验中,DS-8201在HER2阳性BTC患者的ORR为36.4%,DCR更是高达81.8%,相比既往晚期BTC一、二线标准治疗和抗HER2靶向治疗均展现出更优疗效,并且针对HER2低表达患者也有显著获益。这种卓越的抗肿瘤活性与DS-8201的独特机制密切相关。DS-8201是一种新型的抗体药物偶联物(ADC),由曲妥珠单抗和作为细胞毒载药的强效拓扑异构酶I抑制剂通过可裂解的基于四肽的连接子偶联组成,兼具传统化疗和单克隆抗体的优势。不仅能精准靶向肿瘤细胞,并且得益于高活性载药、药物抗体比(DAR)达到8,还能发挥旁观者杀伤效应,大大提高了DS-8201的抗肿瘤活性[20,21]。正是基于这些结构和机制上的优势,使其在增效降毒的同时,还能有效克服HER2肿瘤异质性的影响,针对HER2阳性或者低表达BTC患者均能发挥强效的抗肿瘤杀伤作用。
HERB研究中可以看到,有数例患者在接受DS-8201治疗后获得了相较于其他患者更长期的肿瘤缓解,然而受限于研究样本量较少,以及研究数据披露有限,目前暂无法得知这些患者是否与其HER2表达多少、肿瘤起源、既往治疗类型、或其他因素有关。这就提示对于晚期BTC患者,后续在开展更多DS-8201相关的验证性临床试验的同时,需要进一步深入了解BTC的病理生理学特性,从而将患者进行精准细分,为进一步提升疗效提供思路。
此外,DS8201等这类ADC药物治疗相关的ILD也应得到关注和重视,ILD的具体发病机制尚不明确,临床前研究显示DS-8201的肺毒性可能不是由血液循环时脱落的载药引起,ADC药物诱导的肺泡损伤可能与其被免疫细胞的非靶点依赖性内吞有关,而与依赖HER2蛋白的内吞作用无关。类似的以deruxtecan作为载药但靶向为TROP-2的ADC药物(datopotamab deruxtecan)在非小细胞肺癌的研究中,也观察到了ILD的发生(8%,包括3例致死性事件),进一步证实了ILD来源于非靶点依赖性内吞作用的假设。这些机制和临床治疗常见的化疗药物、TKI或免疫治疗引起的肺炎,可能都不相同,尽管发生ILD后均需要类固醇激素治疗,但筛查诊断、治疗调整和激素治疗方案等会有一些区别,不同的药物引起的肺炎处理的难易程度和严重程度也会不同。当前,DS-8201在多个肿瘤领域都取得了非常好的疗效,应用人群较广,我们应该积极关注和管理它所引起的ILD,避免严重不良反应事件的发生。
点评专家

周军教授
北京大学肿瘤医院
消化肿瘤内科副主任医师
CSCO胆道肿瘤专家委员会常委
CSCO胰腺癌专家委员会常委
CSCO肝癌专家委员会委员
中国抗癌协会胰腺癌专业委员会CSPAC委员
中国老年医学学会肿瘤分会总干事
中国研究型医院消化道肿瘤专委会青委副主委
中国研究型医院学会精准医学与肿瘤MDT专业委员会委员
北京健康促进会肝胆胰中青年专家委员会委员
参考文献:
[1]Akihiro O,Chigusa M,Yasuyuki K,et al.Trastuzumab deruxtecan in patients with HER2-expressing unresectable or recurrent biliary tract cancer:An investigator-initiated multicenter phase 2 study(HERB trial).Oral presentation on 2022 ASCO meeting.
[2]Valle JW,Kelley RK,Nervi B,et al.Biliary tract cancer.Lancet 2021;397:428–44
[3]Wu Q,He XD,Yu L,et al.The Metabolic Syndrome and Risk Factors for Biliary Tract Cancer:A Case-control Study in China.Asian Pacific Journal of Cancer Prevention.2012;Vol13 Issue 5,p1963-1969
[4]Hsing AW,Zhang MD,Rashid A,et al.Hepatitis B and C virus infection and the risk of biliary tract cancer:A population-based study in China.International Journal of Cancer.2007;Vol122 Issue8,p1849-1853
[5]Shebl FM,Andreotti G,Rashid A,et al.Diabetes in relation to biliary tract cancer and stones:a population-based study in Shanghai,China.British Journal of Cancer.2010;Vol103,p115–119
[6]Survival Rates for Bile Duct Cancer.American Cancer Society.https://www.cancer.org/cancer/bile-duct-cancer/detection-diagnosis-staging/survival-by-stage.html
[7]NCCN guideline on Hepatobiliary Cancers,2022 version 2
[8]Tariq NA,McNamara MG,Valle JW.Biliary tract cancers:current knowledge,clinical candidates and future challenges.Cancer Management and Research.Cancer Manag Res.2019 Mar 29;11:2623-2642
[9]Treekitkarnmongkol W,Suthiphongchai T.High expression of ErbB2 contributes to cholangiocarcinoma cell invasion and proliferation through AKT/p70S6K.World J Gastroenterol.2010;16:4047–4054.
[10]Law LY.Dramatic response to trastuzumab and paclitaxel in a patient with human epidermal growth factor receptor 2-positive metastatic cholangiocarcinoma.J.Clin.Oncol.30(27),e271–e273(2012).
[11]Sorscher S.Marked radiographic response of a HER-2-overexpressing biliary cancer to trastuzumab.Cancer Manag.Res.2013;6,1–3
[12]Hyman DM,Piha-Paul SA,Won H et al.HER kinase inhibition in patients with HER2-and HER3-mutant cancers.Nature.2018;554(7691),189–194
[13]Javle M,Borad MJ,Azad NS,et al.Pertuzumab and trastuzumab for HER2-positive,metastatic biliary tract cancer(MyPathway):a multicentre,open-label,phase 2a,multiple basket study.Lancet Oncol.2021;22(9),1290–1300
[14]Mondaca S,Razavi P,Xu C,et al.Genomic characterization of ERBB2-driven biliary cancer and a case of response to ado-trastuzumab emtansine.JCO Precis.Oncol.2019;3(3),1–9.
[15]Lorena MB,Essa AM,Taofic M,et al.Biliary tract cancers:epidemiology,molecular pathogenesis and genetic risk associations.Chin Clin Oncol.2016 Oct;5(5):61.
[16]Vivaldi C,Fornaro L,Ugolini C,et al.HER2 Overexpression as a Poor Prognostic Determinant in Resected Biliary Tract Cancer.Oncologist.2020 Oct;25(10):886–893
[17]Kim HS,Kim R,Kim HR,et al.HER2 Aberrations as a Novel Marker in Advanced Biliary Tract Cancer.Front Oncol.2022 Feb 14;12:834104
[18]Nam AR,Kim JW,Cha YJ,et al.Therapeutic implication of HER2 in advanced biliary tract cancer.Oncotarget.2016 Sep 6;7(36):58007–58021.
[19]Jeong H,Jeong JH,Kim PY,et al.Feasibility of HER2-Targeted Therapy in Advanced Biliary Tract Cancer:A Prospective Pilot Study of Trastuzumab Biosimilar in Combination with Gemcitabine Plus Cisplatin.Cancers 2021,13,161.
[20]Ogitani Y,Aida T,Hagihara K et al.DS-8201a,A novel HER2-targeting ADC with a novel DNA topoisomerase I inhibitor,demonstrates a promising antitumor efficacy with differentiation from T-DM1.Clin.Cancer Res.2016;22(20),5097–5108
[21]Ogitani Y,Hagihara K,Oitate M,Naito H,Agatsuma T.Bystander killing effect of DS-8201a,a novel anti-human epidermal growth factor receptor 2 antibody–drug conjugate,in tumors with human epidermal growth factor receptor 2 heterogeneity.Cancer Sci.2016;107(7),1039–1046
*此文仅用于向医学人士提供科学信息,不代表本平台观点

| 留言与评论(共有 0 条评论) “” |