
是不是觉得在一个人的衰老过程中,每一个细胞的衰老都不是无辜的?的确,衰老细胞会通过分泌炎性因子诱发慢性炎症,还直接和干细胞衰竭挂钩[1]。
2013年的衰老标识大评选(Cell衰老学经典巨制《The hallmarks of aging》)中,细胞衰老凭借着强大的促衰能力,成功位列九大衰老标识之一[2]。自此,衰老细胞清除策略(senolytics)相关研究在衰老生物学领域备受关注,长盛不衰[3-4]。
难道衰老细胞真的只能促衰吗?加州大学旧金山分校的华裔教授Tien Peng、博士后研究员Nabora S. Reyes等,近日在《Science》正刊上发表的文章颠覆了这一观点:年轻组织中的衰老细胞可有效促进组织器官修复和再生[5]。


要讨论这项衰老细胞的颠覆性作用,不得不提到一种衰老细胞中的关键蛋白:p16INK4α。p16INK4α是一种和细胞周期调控密切相关的蛋白,随着它的表达增加,一个细胞会慢慢停止分裂增殖的复制周期,进入“低能耗”状态[6]。
除了停止增殖,p16INK4α阳性细胞也表现出广泛的衰老细胞特征:衰老相关分泌表型、衰老细胞形态和经典衰老标记。

图注:衰老细胞的部分特征
衰老相关分泌表型
p16INK4α阳性细胞中衰老相关分泌表型SASP编码基因显著表达:如白细胞介素6(IL6)、趋化因子8(CCL8)等。

图注:肺泡及其基底膜上表达p16INK4α蛋白的细胞的SASP表达情况
细胞形态变化
同时,p16INK4α阳性细胞大多存在两个或多个细胞核,细胞体积一定程度变大,也是细胞走向衰老的典型形态特征。
存在衰老经典标记
p16INK4α阳性细胞中还广泛存在DNA损伤标记物和β-半乳糖苷酶,这些都是在之前文献中受到广泛证实的衰老标记物。
三重验证下,研究者们核实了p16INK4α的衰老细胞关键标志身份,p16INK4α正式上岗“衰老哨兵”。

之前的研究中已经证实了p16INK4α阳性细胞在年轻成人组织中的存在[7],表明它们可能具有一些正常的生理功能。为了验证这一点,研究者们去重复探究了不同年龄生物体内衰老细胞的分布。
他们发现:衰老细胞不仅存在于衰老个体,在年轻个体的健康组织中也广泛存在,只不过衰老个体中衰老细胞的数量要远超年轻个体。
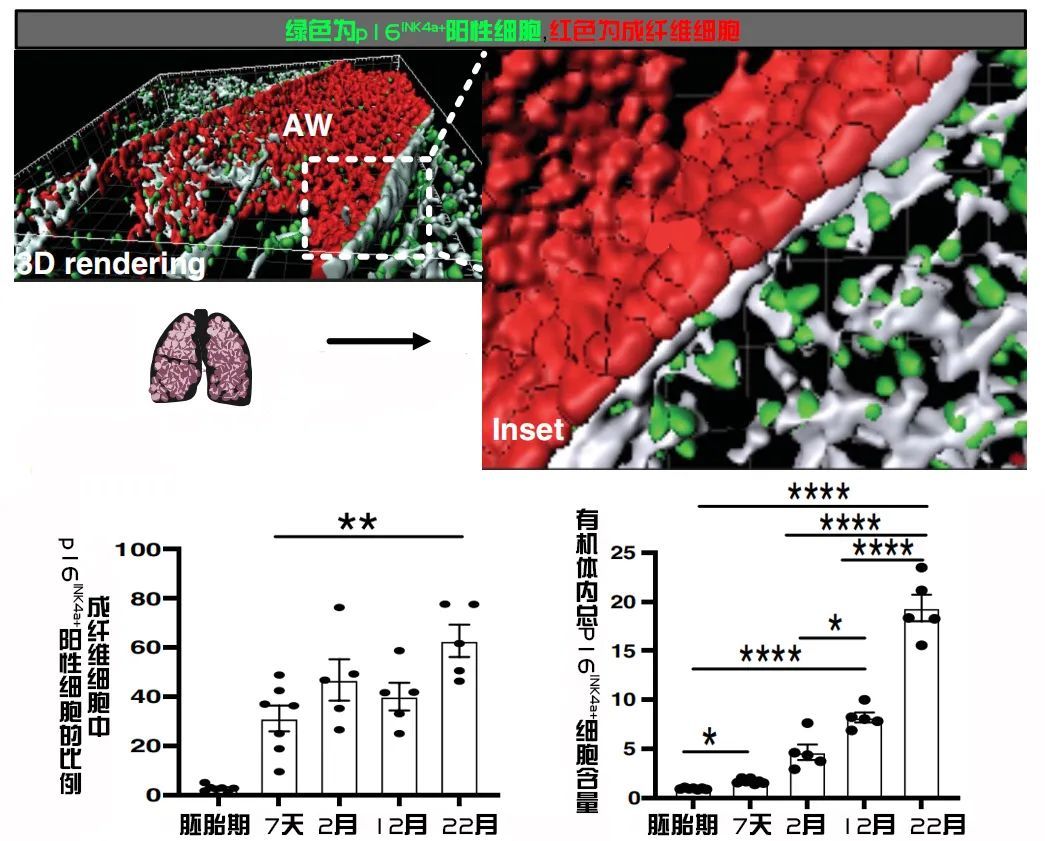
图注:在年轻小鼠肺中检测到的衰老成纤维细胞(上),p16INK4α阳性细胞在生命早期就出现在了身体里,并随年龄增加而增多(下)
这些出现在年轻个体健康组织中的p16INK4α阳性细胞主要集中在两个群体中:成纤维细胞和白细胞,它们集中存在于各个器官的基底膜周围,并在生命早期就开始出现,长期存在。
基底膜存在于各个器官的表层,它不仅支持器官的细胞层,还通过影响细胞粘附、迁移、增殖和分化对组织形成产生重要作用。
随着年龄的增长,生物体内p16INK4α阳性衰老细胞数量不断攀升,但是它们在基底膜细胞总数中所占的比例却不会发生很大的改变,也就是说,它们其实是器官组织中的常备功能性成分,而非机体衰老的产物。
与之相反的是,器官损伤却会造成p16INK4α阳性细胞比例的上升,也正是这一点引起了研究者们的注意:p16INK4α阳性细胞难道和器官组织的修复和再生有关?
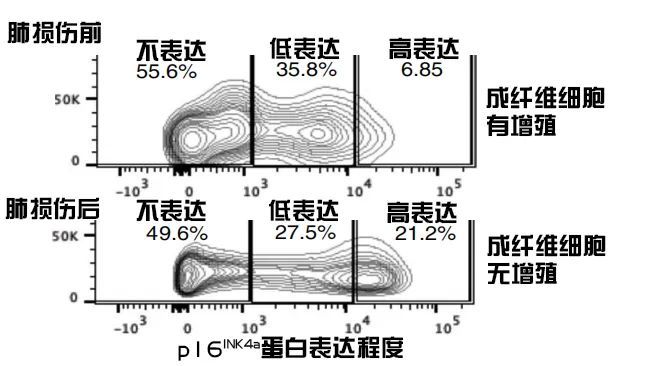
图注:器官损伤也会造成p16INK4α阳性细胞比例的上升

带着“衰老细胞能修复组织”的猜想,研究者们针对年轻组织中的p16INK4α阳性成纤维细胞展开了实验。
在损伤小鼠肺组织后,他们用经典衰老细胞清除药组合达沙替尼+槲皮素(D&Q)处理小鼠。经检测,D&Q组合立竿见影,p16INK4α阳性衰老细胞被清除殆尽,但小鼠并没有表现出先前文献中健康延寿的效果,相反,小鼠的损伤肺组织再生停滞了下来。
把这个过程仔细拆解分析,研究者们才发现,组织修复的过程依赖于衰老细胞分泌的SASP内的一种因子:Ereg(上皮调节蛋白)。
Ereg是一种生长因子,可以促进细胞的生长和分裂增殖。正是这种SASP为组织修复提供了源源动力,在Ereg的催促下,组织中的干细胞开始努力工作,分裂出新鲜的细胞来填补组织损伤带来的细胞亏空。

图注:达沙替尼+槲皮素(D&Q)清除衰老细胞的同时,修复组织的干细胞的活化也被抑制了
经研究,在损伤的基底膜周围,在p16INK4α蛋白的作用下,衰老成纤维细胞上会富集白细胞介素1受体,而白细胞会富集白细胞介素1,这种炎性因子受体的激活会极大地促进经典炎性相关因子NF-κB表达,继而调控其下游SASP因子Ereg的分泌。
当p16INK4α表达被抑制的时候,衰老细胞内其他SASP不变,但是Ereg和另一种SASP因子的分泌会显著下调。实验小鼠的组织器官形态不受影响,但是损伤修复停滞,干细胞活性也会远低于对照组小鼠。也就是说,p16INK4α的表达直接和衰老细胞的促进修复损伤作用相关。
衰老细胞用它的标志性蛋白p16INK4α向衰老生物学及其研究者们发出了第一声呐喊:衰老细胞不仅广泛存在于健康的年轻组织中,还能发挥推进机体健康的作用(促进损伤修复和组织再生)。
这种促进损伤修复和组织再生的能力也不是个例。在其他地方,衰老细胞也在默默发挥着各种重要的作用,如在失血休克中保护主要器官[8]。在许多研究者的努力下,衰老细胞的“身份”正在默默扭转。
本研究题为《Sentinel p16INK4a+ cells in the basement membrane form a reparative niche in the lung》,发表于生物学顶尖期刊《Science》。通讯作者为加州大学旧金山分校华裔教授Tien Peng,第一作者为加州大学旧金山分校博士后研究员Nabora S. Reyes。这项工作得到了美国国立卫生研究院(DP2AG056034、R01HL142552、R01HL155622、F32HL14226、P30DK06372、P30DK063720)、烟草相关疾病研究计划(新调查员奖)和肺动脉高压协会的支持。
—— TIMEPIE ——
参考文献
[1] Birch, J., & Gil, J. (2020). Senescence and the SASP: many therapeutic avenues. Genes & development, 34(23-24), 1565–1576. https://doi.org/10.1101/gad.343129.120
[2] López-Otín, C., Blasco, M. A., Partridge, L., Serrano, M., & Kroemer, G. (2013). The hallmarks of aging. Cell, 153(6), 1194–1217. https://doi.org/10.1016/j.cell.2013.05.039
[3] Hickson, L. J., Langhi Prata, L., Bobart, S. A., Evans, T. K., Giorgadze, N., Hashmi, S. K., Herrmann, S. M., Jensen, M. D., Jia, Q., Jordan, K. L., Kellogg, T. A., Khosla, S., Koerber, D. M., Lagnado, A. B., Lawson, D. K., LeBrasseur, N. K., Lerman, L. O., McDonald, K. M., McKenzie, T. J., Passos, J. F., … Kirkland, J. L. (2019). Senolytics decrease senescent cells in humans: Preliminary report from a clinical trial of Dasatinib plus Quercetin in individuals with diabetic kidney disease. EBioMedicine, 47, 446–456. https://doi.org/10.1016/j.ebiom.2019.08.069
[4] Xu, Q., Fu, Q., Li, Z., Liu, H., Wang, Y., Lin, X., He, R., Zhang, X., Ju, Z., Campisi, J., Kirkland, J. L., & Sun, Y. (2021). The flavonoid procyanidin C1 has senotherapeutic activity and increases lifespan in mice. Nature metabolism, 3(12), 1706–1726. https://doi.org/10.1038/s42255-021-00491-8
[5] Reyes, N. S., Krasilnikov, M., Allen, N. C., Lee, J. Y., Hyams, B., Zhou, M., Ravishankar, S., Cassandras, M., Wang, C., Khan, I., Matatia, P., Johmura, Y., Molofsky, A., Matthay, M., Nakanishi, M., Sheppard, D., Campisi, J., & Peng, T. (2022). Sentinel p16INK4a+ cells in the basement membrane form a reparative niche in the lung. Science (New York, N.Y.), 378(6616), 192–201. https://doi.org/10.1126/science.abf3326
[6] Gan, Q., Huang, J., Zhou, R., Niu, J., Zhu, X., Wang, J., Zhang, Z., & Tong, T. (2008). PPAR{gamma} accelerates cellular senescence by inducing p16INK4{alpha} expression in human diploid fibroblasts. Journal of cell science, 121(Pt 13), 2235–2245. https://doi.org/10.1242/jcs.026633
[7] Grosse, L., Wagner, N., Emelyanov, A., Molina, C., Lacas-Gervais, S., Wagner, K. D., & Bulavin, D. V. (2020). Defined p16High Senescent Cell Types Are Indispensable for Mouse Healthspan. Cell metabolism, 32(1), 87–99.e6. https://doi.org/10.1016/j.cmet.2020.05.002
[8] Chu, X., Wen, J., & Raju, R. P. (2020). Rapid senescence-like response after acute injury. Aging cell, 19(9), e13201. https://doi.org/10.1111/acel.13201
| 留言与评论(共有 0 条评论) “” |