*仅供医学专业人士阅读参考
且看T-DXd一线治疗乳腺癌的初步研究结果。
基于DESTINY-Breast03(DB03)研究的大幅度生存获益,T-DXd已经取代T-DM1成为HER2阳性晚期乳腺癌的二线治疗标准方案。2022年SABCS大会中公布的DB03研究随访数据再次刷新T-DXd二线治疗的无进展生存期(PFS)获益记录,将是HER2阳性晚期乳腺癌的获益天花板,其他药物很难超越[1,2]。从后线到前线,T-DXd探索无止境,本次SABCS大会还发布了两项T-DXd一线治疗晚期乳腺癌(HER2阳性、HER2-low)的研究成果[3,4],支持T-DXd单药或联合方案在晚期乳腺癌一线治疗的应用,进一步拓宽T-DXd的获益人群。DB07:T-DXd联合的多模式探索,一线治疗HER2阳性晚期乳腺癌
DESTINY-Breast07(DB07)是一项评估T-DXd联合其他抗癌药物用于HER2阳性晚期乳腺癌的ⅠB/Ⅱ期研究。该研究的第一部分为剂量探索阶段,包括T-DXd+度伐利尤单抗、帕妥珠单抗、紫杉醇、度伐利尤单抗+紫杉醇、图卡替尼等5个模块;第二部分为剂量扩展阶段,包括T-DXd单药、前述5个模块以及T-DXd单药或联合图卡替尼用于活动性脑转移患者等8个模块(0-7模块)。主要终点是安全性和耐受性,并确定Ⅱ期推荐剂量(RP2D)。
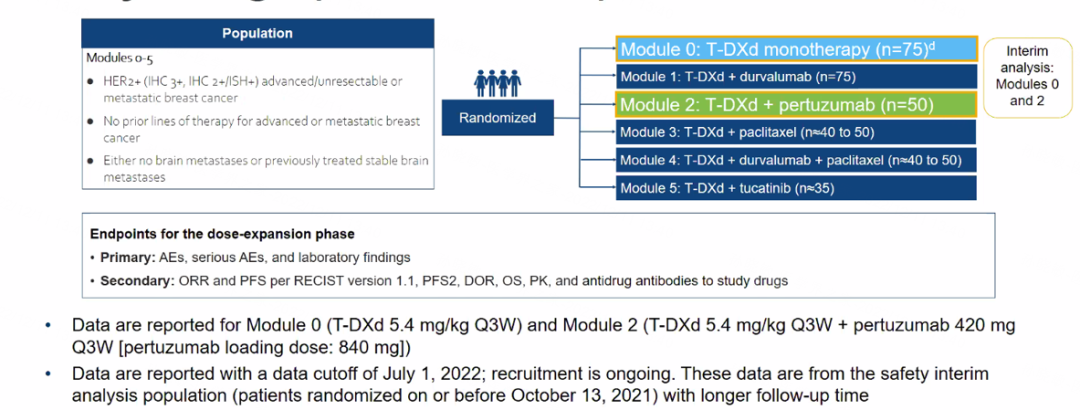
图1. DB07研究设计
此前,2022年ASCO大会报道了T-DXd+帕妥珠单抗的剂量探索结果,确定该方案的RP2D为T-DXd 5.4 mg/kg Q3W+帕妥珠单抗420mg,其中帕妥珠单抗的负荷剂量840mg[5]。本次SABCS大会公布了T-DXd单药与此联合方案一线治疗HER2阳性晚期乳腺癌的初步分析结果[3]。
截至2022年7月1日,单药组共纳入23例患者,联合组共22例患者,两组分别有73.9%和72.7%的患者继续接受治疗,中位随访时间分别为11.0个月和10.0个月,患者的人口统计学和临床特征基本一致。在安全性方面,≥3级不良反应事件(AE)的发生率分别为30.4%和40.9%,严重AE发生率分别为8.7%和13.6%。单药组中1例患者发生药物相关间质性肺病(ILD)/肺炎。两组各发生1例死亡事件。在疾病缓解方面,单药组中87.0%的患者观察到肿瘤缩小,联合组中为81.8%。临床前研究表明,与单独给药相比,T-DXd联合帕妥珠单抗可更快速有效地内化,更大程度地降低HER2蛋白总量,并增强HER2表达细胞的内化。

图2. T-DXd单药治疗靶病灶大小的最佳百分比变化
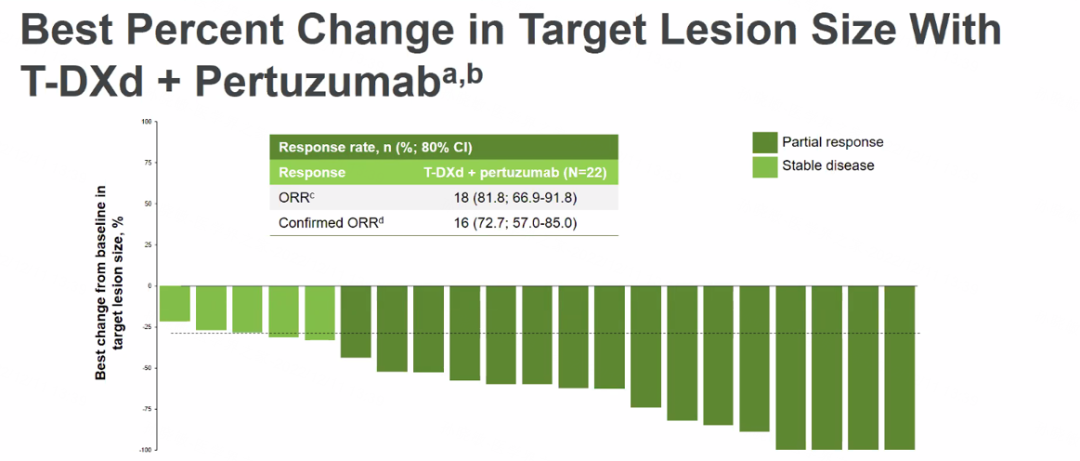
图3. T-DXd联合帕妥珠单抗治疗靶病灶大小的最佳百分比变化
总体而言,T-DXd单药和联合帕妥珠单抗一线治疗HER2阳性晚期乳腺癌均展现出具有前景的抗肿瘤活性,并且不良反应特征与T-DXd既往研究中报告的一致。临床前研究表明,帕妥珠单抗可能诱导T-DXd内化和抑制HER2驱动的信号传导。这些结果支持T-DXd单药或联合帕妥珠单抗一线治疗在更大型临床试验的应用。目前正在进行的Ⅲ期临床研究DESTINY-Breast09(DB09)将评估T-DXd联合或不联合帕妥珠单抗相比曲妥珠单抗+帕妥珠单抗+紫杉类化疗一线治疗HER2阳性晚期乳腺癌的疗效和安全性,是T-DXd正面挑战当前一线标准治疗方案的首个临床研究,期待此研究的成功重新定义HER2阳性晚期乳腺癌一线治疗的新标准,进一步推动T-DXd在HER2阳性晚期乳腺癌的前线应用。
BEGONIA:T-DXd联合度伐利尤单抗一线治疗三阴性乳腺癌
此外,本次大会中还更新了BEGONIA研究中T-DXd联合度伐利尤单抗(队列6)的第二部分结果[4]。BEGONIA研究是一项正在进行的多中心、多臂、开放标签的Ⅰb/Ⅱ期临床试验,旨在评价度伐利尤单抗联合其他疗法(包括ADC)用于晚期/转移性三阴性乳腺癌(TNBC)一线治疗的疗效和安全性。其中,队列6纳入HR阴性/HER2-low(IHC2+/ISH-、IHC1+/ISH-)患者,主要终点为安全性和耐受性。
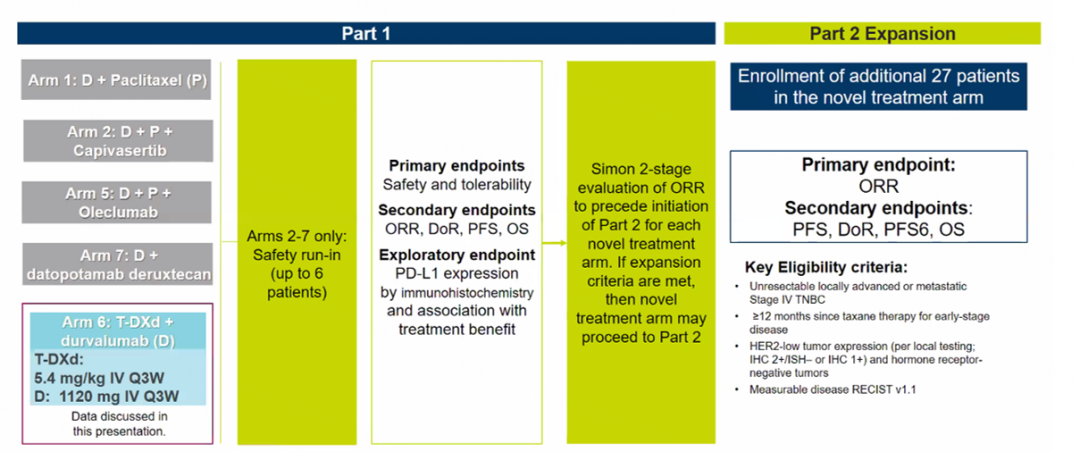
图4. BEGONIA研究设计
截至2022年7月22日,队列6中共有58例患者接受了T-DXd+度伐利尤单抗治疗,其中28例患者仍在治疗中,10例患者因AE停用联合治疗,19例患者因疾病进展停用,4例患者因其他原因停用。中位随访时间为13.4个月。疗效评估显示,联合治疗的确认客观缓解率(ORR)为56.9%,IHC1+和IHC2+的患者分别为67.6%和38.1%。
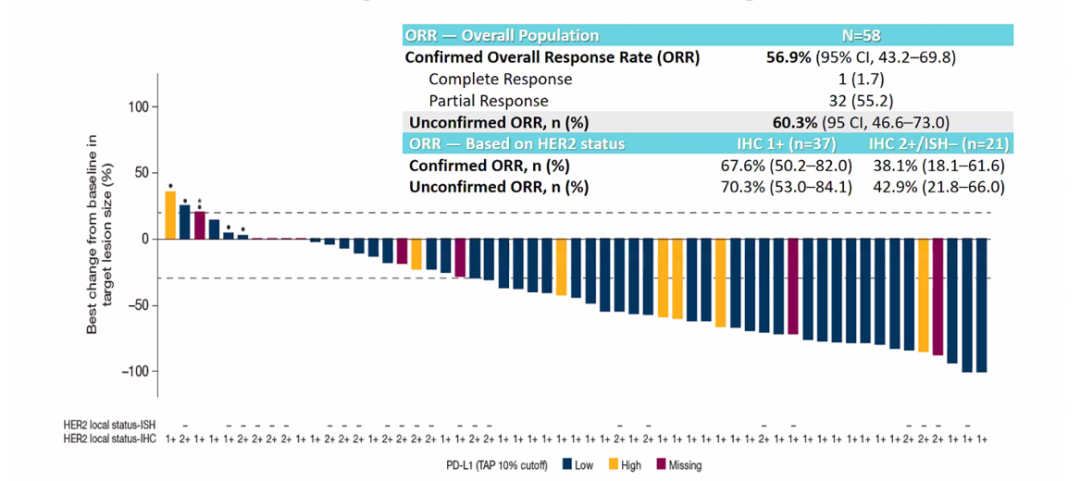
图5. 队列6中靶病灶大小的最佳百分比变化
在安全性方面,未报告剂量限制性毒性。常见AE主要是胃肠道和血液学;3/4级AE主要是血液学,最常见的是中性粒细胞减少(22.4%)和贫血(8.6%)。17.2%的患者因AE导致联合治疗停药,55.2%的患者因AE导致剂量中断。度伐利尤单抗相关≥10%的特殊影响AE(AESI)包括腹泻、甲状腺功能减退、ILD/非感染性肺炎和皮疹,大多数病例为1/2级。T-DXd治疗≥10%的AESI为ILD/非感染性肺炎,大多数病例为1/2级。对于HR阴性/HER2-low的晚期TNBC患者,T-DXd联合度伐利尤单抗一线治疗显示出可耐受且可管理的安全性特征,与单个药物的已知特征一致。

图6. 安全性
BEGONIA研究更新的结果再次证明了T-DXd联合度伐利尤单抗一线治疗HR阴性/HER2-low晚期乳腺癌显示了良好的缓解率和安全性,且安全性良好,没有观察到剂量限制性毒性。支持此一线联合方案在HR阴性/HER2-low晚期乳腺癌的应用。
专家点评
挑战HER2阳性晚期乳腺癌一线治疗,DB07研究再次证实T-DXd的强效抗肿瘤活性
T-Dxd由曲妥珠单抗、可裂解四肽连接子和拓扑异构酶Ⅰ抑制剂(Dxd)组成。机制独特的高活性载药、优化的连接子技术、高DAR和强效旁观者效应等共同构成了T-DXd取得突破性临床获益的基础。早在2019年,基于DESTINY-Breast01(DB01)研究的惊艳疗效[6],FDA附条件加速批准T-DXd用于HER2阳性晚期乳腺癌的后线治疗,开启了T-Dxd在HER2阳性乳腺癌的“升级打怪之旅”。
从DB02到DB03[1-2,7],T-DXd通过与当前的标准治疗方案进行头对头比较,无论是ORR、PFS还是总生存期(OS),均取得了突破性获益,从后线逐渐前移一步步改写治疗标准,最终确定了T-DXd在晚期二线的标准治疗地位,同时也为后续挑战一线奠定了疗效基础。
DB07研究在HER2阳性晚期/转移性乳腺癌患者中评估T-DXd联合其他抗癌药物的疗效和安全性。该研究的第二部分纳入既往未接受过治疗的转移性乳腺癌患者,本次SABCS大会中更新的数据显示,单药组和联合组中ORR分别87.0%和81.8%。从数据上来看,联合帕妥珠单抗似乎并未进一步改善HER2阳性晚期乳腺癌一线治疗获益。但临床前研究提示,帕妥珠单抗可能诱导T-DXd的内化,联合治疗可抑制HER2驱动的信号传导。T-DXd与帕妥珠单抗联合是否具有协同增效或叠加作用尚无定论,未来还需进一步探索。基于既往T-DXd二线及以后治疗的研究数据,T-DXd单药即可取得突破性生存获益,在一线治疗中是否需要联合帕妥珠单抗,期待DB09研究解答这一疑问。
BEGONIA研究为T-DXd联合免疫治疗TNBC提供初步临床证据
TNBC指的是ER、PR和HER2均表达阴性的乳腺癌,约占所有乳腺癌人群的10%-15%[8]。在传统概念认知下,三阴性乳腺癌缺乏特异性治疗靶点,相比其他亚型预后往往较差。对于晚期TNBC患者而言,一线单药化疗或联合化疗的中位PFS并不理想,虽然免疫治疗一定程度改善了晚期TNBC患者的治疗获益,但其仅针对PD-L1表达阳性患者有效。有研究显示,传统TNBC中存在36.6%的HER2-low患者[9],如果HR阴性/HER2-low乳腺癌患者能够从抗HER2治疗中获益,将在一定程度满足TNBC人群中未被满足的治疗需要。
DESTINY-Breast04(DB04)研究的探索性终点显示,在既往接受过1-2线晚期化疗的HR阴性/HER2-low患者中,相比化疗组,T-DXd组的中位PFS(8.5个月 vs 2.9个月)和中位OS(18.2个月 vs 8.3个月)均有显著改善(HR=0.48,95% CI, 0.24-0.95),表明T-DXd也能为HR阴性/HER2-low患者带来显著的生存获益。
BEGONIA研究的队列6则在既往未接受过治疗的不可切除、局部晚期或转移性TNBC(HR阴性/HER2-low)患者中评估T-DXd联合度伐利尤单抗的安全性、耐受性和初步疗效。最新的研究结果显示,T-DXd联合度伐利尤单抗一线治疗HR阴性/HER2-low患者的ORR达56.9%,其中IHC1+队列的获益更为显著(67.6%),为T-DXd联合方案一线治疗HER2-low晚期乳腺癌增加了新的循证医学证据。
上述两项研究表明,T-DXd单药或联合方案在晚期乳腺癌一线治疗中展现出治疗前景,进一步支持在Ⅲ期临床试验中验证这些方案的一线治疗获益。期待T-DXd在HER2表达的晚期乳腺癌一线治疗中同样迎来突破性获益,推动T-DXd用于HER2阳性晚期乳腺癌一线适应症的获批,并且再次改写HER2阳性乳腺癌治疗标准。
专家简介

郝春芳
天津医科大学肿瘤医院乳腺内科
医学博士 副主任医师
中国抗癌协会乳腺癌专业委员会委员
中国临床肿瘤学会(CSCO)乳腺癌专家委员会委员
中国抗癌协会肿瘤防治科普专业委员会委员
中国医药教育协会乳腺疾病专业委员会委员
北京乳腺病防治学会健康管理专业委员会常务委员
北京乳腺病防治学会国际医疗与合作专业委员会常务委员
北京癌症防治学会乳腺癌专业委员会青委会副主任委员
参考文献:
[1].Cortés J, Kim S, Chung W, et al; Trastuzumab deruxtecan (T-DXd) vs trastuzumab emtansine (T-DM1) in patients (Pts) with HER2+ metastatic breast cancer (mBC):Results of the randomized phase III DESTINY-Breast03 study. 2021 ESMO. LBA1.
[2].Hegg R, Chung WP, Im SA, et al;Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: Updated survival results of the randomized, phase 3 study DESTINY-Breast03. 2022 SABCS. GS2-02
[3].Hamilton E, Jhaveri K, Loi S, et al; Dose-Expansion Study of Trastuzumab Deruxtecan as Monotherapy or Combined With Pertuzumab in Patients With Metastatic Human Epidermal Growth Factor Receptor 2-Positive (HER2+) Breast Cancer in DESTINY-Breast07 (DB-07). 2022 SABCS. PD18-11.
[4].Schmid P, Wysocki P, Park YH, et al; Trastuzumab deruxtecan (T-DXd) + durvalumab (D) as first-line (1L) treatment for unresectable locally advanced/metastatic hormone receptor-negative (HR−), HER2-low breast cancer: updated results from BEGONIA, a phase 1b/2 study. 2022 SABCS. PD11-08.
[5].Andre F, Hamilton EP, Loi S, et al; Dose-finding and -expansion studies of trastuzumab deruxtecan in combination with other anti-cancer agents in patients (pts) with advanced/metastatic HER2+ (DESTINY-Breast07 [DB-07]) and HER2-low (DESTINY-Breast08 [DB-08]) breast cancer (BC). 2022 ASCO. 3025.
[6].Modi S, Saura C, Yamashita T, et al; DESTINY-Breast01 Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. N Engl J Med. 2020 Feb 13;382(7):610-621.
[7].Krop I, Yeon H. Park YH, Kim SB, et al; Trastuzumab deruxtecan vs physician’s choice in patients with HER2+ unresectable and/or metastatic breast cancer previously treated with trastuzumab emtansine: primary results of the randomized, phase 3 study DESTINY-Breast02. 2022 SABCS. GS2-01.
[8].Won KA, Spruck C. Triple‑negative breast cancer therapy: Current and future perspectives (Review). Int J Oncol. 2020 Dec;57(6):1245-1261.
[9].Schettini F, Chic N, Brasó-Maristany F,et al. Clinical, pathological, and PAM50 gene expression features of HER2-low breast cancer. NPJ Breast Cancer. 2021 Jan 4;7(1):1.
[10].Modi S, Jacot W, Yamashita T, et al; DESTINY-Breast04 Trial Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |