*仅供医学专业人士阅读参考
CLDN18.2有望成为继HER2后第二个明星靶点,多项研究正如火如荼展开。
胃癌是全球范围内常见的恶性肿瘤之一,目前传统化疗仍是晚期胃癌治疗的基石,但传统化疗的治疗效果有限。近年来,靶向治疗和免疫治疗在多种恶性肿瘤的治疗中发挥了越来越多的作用,但在胃癌领域,除了HER2阳性胃癌应用曲妥珠单抗可改善生存外,HER2阴性患者的治疗手段仍比较匮乏。根据不同胃癌患者的分子生物学特征,开发具有针对性的靶向疗法,正在成为胃癌治疗的新模式。2022年12月18日,由创胜集团主办的“创新致胜,胃爱而生”专栏发起线上讨论会,邀请胃癌相关学科一线专家,全面梳理晚期胃癌诊治最新研究成果,探讨胃癌诊疗中遇到的相关问题及新的诊疗理念。
大会邀请天津医科大学肿瘤医院巴一教授和北京大学肿瘤医院张小田教授担任会议主席,两位教授在开场致辞中表示,精准治疗已经成为了胃癌治疗的重要思路,寻找新靶点,根据患者的基因特征和分子分型来筛选相应的靶向药物,给予患者个体化治疗,是胃癌靶向治疗的必然趋势。相信此次学术盛会的召开将进一步拓展胃癌诊疗领域的交流与合作,助力我国胃癌防治事业再上新征程。
图1. 天津医科大学肿瘤医院巴一教授和北京大学肿瘤医院张小田教授
靶向、免疫强强出击,打造晚期胃癌诊疗新体系
会议伊始,创胜集团戚川博士介绍了创胜集团当前的重点研发管线,创胜集团是一家临床阶段的在生物药发现、研发、工艺开发和生产方面具有全面综合能力的生物制药公司。创胜集团的开发管线涵盖肿瘤、骨科和肾病等多种领域。全体创胜人奋勇前行、追求创新,顺利达成了一系列的重要里程碑。其中,核心产品CLDN18.2人源化单抗TST001在中国、美国进行同步开发,当前正处于II期临床研究阶段。除TST001之外,创胜集团还建立和推进了丰富多样且互补协同的其他肿瘤产品管线的开发,包括MSB0254、TST010等,这些候选药物临床上不仅可以作为单药治疗,也可与TST001联用,均取得了不同程度的进展。未来,创胜集团将一如既往致力于运用前沿科技研发具有竞争性的优质创新生物药,充分发掘产品组合的潜力,为患者带来更多有效且可支付得起的生物疗法。

图2. 创胜集团戚川博士
胃癌是最常见的恶性肿瘤之一,近年来,随着一批新药的涌现,胃癌的治疗方案已不断更新迭代,吉林大学第一医院王畅教授详细阐述了晚期胃癌治疗进展。

图3. 吉林大学第一医院王畅教授
HER2是胃癌的重要治疗靶点,ToGA试验证实了曲妥珠单抗在HER2阳性晚期胃癌的一线治疗地位[1],抗体偶联药物(ADC)能够显著改善HER2阳性晚期胃癌后线的生存时间[2]。美国食品药品监督管理局(FDA)已加速批准帕博利珠单抗联合曲妥珠单抗、化疗药物用于局部晚期不可切除或转移性HER2阳性胃癌或胃食管交界腺癌患者的一线治疗。HER2双抗KN026联合PD-L1/CTLA-4双抗KN046在未经治疗的HER2阳性胃癌中显示出临床获益[3]。
在HER2阴性胃癌的一线治疗中,纳武利尤单抗单抗、信迪利单抗、帕博利珠单抗等PD-1单抗均取得了阳性结果[4-6]。在HER2阴性胃癌二线治疗中,雷莫西尤单抗联合紫杉醇成为了晚期胃癌二线治疗的新标准[7]。在HER2阴性胃癌后线治疗中,纳武单抗和阿帕替尼为≥2线治疗失败的胃癌患者带来临床获益[8,9]。
胃癌具有非常高的异质性,生物学行为、临床性质差异较大。根据分子类型不同,可以分为EBV病毒阳性胃癌、微卫星不稳定(MSI)胃癌、基因组稳定型胃癌以及染色体不稳定型胃癌4种类型[10]。NGS检测发现,EBV病毒是胃癌免疫治疗的疗效预测指标[11]。临床研究证实,微卫星高度不稳定(MSI-H)患者和高肿瘤突变负荷(TMB-H)肿瘤患者采用免疫治疗显示出具有临床价值的疗效改善[12,13]。目前医学界正在对FGFR2b、cMET、MUC17等新靶点进展研究,这些标志物可能指导未来治疗方案的临床决策,胃癌诊疗正逐步走向多个靶点共同指导的精准治疗新时代。
随后北京大学肿瘤医院彭智教授解读了晚期胃癌新兴靶点研究进展,晚期胃癌的系统性治疗仍以化疗为基石,免疫、靶向治疗取得进展但仍有局限,新靶点的鉴定和药物开发在持续进行中。
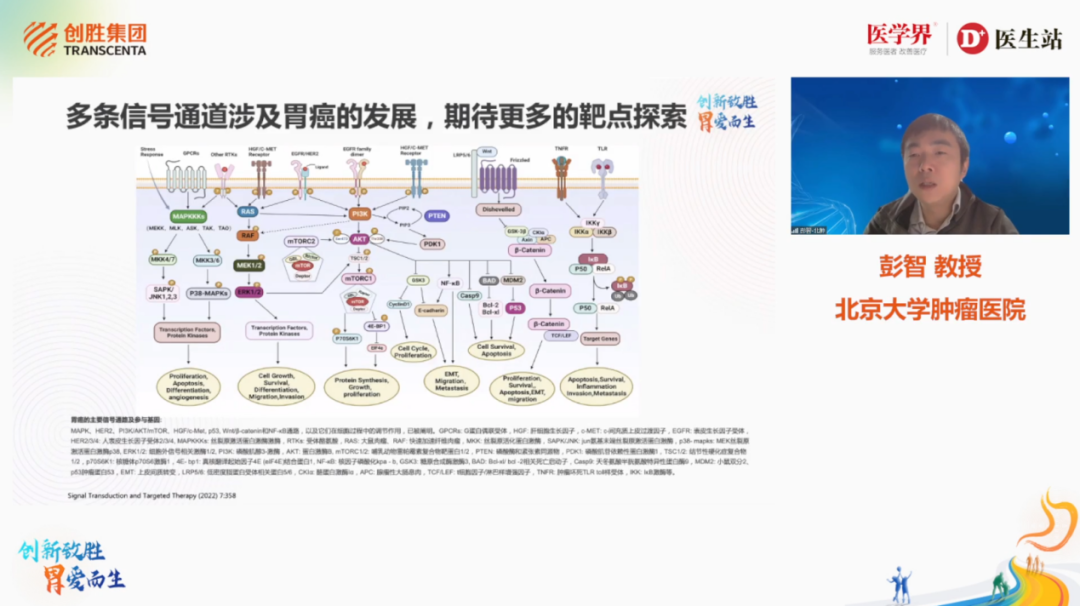
图4. 北京大学肿瘤医院彭智教授
EGFR:EGFR在蛋白质水平上的表达为 30%-60%[14],EGFR 扩增胃食管癌患者能从EGFR抑制剂治疗中获益[15]。
FGFR2b:30.2%的晚期胃癌显示FGFR2b阳性[16],II期FIGHT研究取得阳性结果,与化疗组相比,Bemarituzumab联合化疗组患者的无进展生存期(PFS)、总生存期(OS)和客观缓解率(ORR)得到显著改善[17]。
CLDN18.2:36%的晚期胃癌CLDN18.2高表达[18],Zolbetuximab是一种小鼠嵌合单克隆抗体,其一线治疗的FAST研究取得阳性结果,SPOTLIGHT、GLOW 研究达到主要终点,数据待公布[19]。TST001是一种人源化抗体,可特异性地结合CLDN18.2,在晚期胃癌一线治疗的研究中显示出可喜的疗效[20]。
MET:MET扩增/过表达在晚期胃癌中较常见,是胃癌患者的不良预后因素[21]。MET抑制剂可为MET 扩增胃癌患者带来新选择[22]。
DKK1:DisTinGuish研究中,DKK高表达占比57%[23]。DKN-01是一种针对DKK1的中和抗体,DKN01联合PD-1单抗一线治疗晚期胃癌的疗效可期[23]。
RHOA:Ras同源家族成员A(RhoA)参与多种细胞过程,包括细胞骨架调节和肌动蛋白-肌球蛋白收缩能力等。RHOA突变与弥漫型胃癌的形成有关[24]。
FAK:FAK高表达与胃癌不良预后相关[25],FAK抑制剂在二线及以上的晚期胃癌患者中观察到初步疗效[26]。
TROP-2:TROP2为泛癌种的治疗靶点,在多个癌症队列中显示出疗效,其中5例胃癌,4例疾病稳定(SD)[27]。
MUC17:MUC17在23.3%-52.2%的胃癌患者中过度表达[28],一项靶向MUC17阳性和CD3阳性的I期试验正在进行中。
胃癌异质性强,且涉及多条信号通路,基于生物标志物指导的治疗是未来的发展方向。在吉林大学第一医院崔久嵬教授的主持下,天津医科大学总医院刘畅教授、中国医科大学附属第一医院宋娜教授和郑州大学第一附属医院张伟杰教授结合自身的临床经验,针对精准治疗时代的晚期胃癌一线治疗分享了各自的观点:
对于HER2过表达阳性的腺癌患者,应在一线化疗中加入曲妥珠单抗,免疫疗法也可加入该方案治疗HER2过表达阳性腺癌。
中国的胃癌患者绝大多数都是HER2阴性人群,一线治疗方案可在化疗基础上联合免疫治疗。
CLDN18.2等多个治疗性靶点及靶向药物正在研究当中,将为晚期HER2阴性胃癌的一线治疗打开全新的局面。
图5. 讨论嘉宾
聚焦黄金靶点CLDN18.2,再燃HER2阴性胃癌靶向治疗希望
Claudin 18.2(CLDN18.2)是在细胞紧密连接中的一种重要蛋白质,在各种原发性恶性肿瘤的发生和发展过程中经常出现异常表达。天津医科大学肿瘤医院刘锐教授带来“CLDN18.2:晚期胃癌潜力的Biomarker”主题报告,表示胃癌分类复杂且异质性强,生物标志物的鉴定和临床药物开发可为晚期胃癌患者带来生存改善。Claudin家族参与肿瘤形成,CLDN18.2在胃组织特异的表达模式其使其成为胃癌药物开发的理想靶点。研究显示CLDN18.2阳性与更高诊断分期和EBV病毒感染相关[29],CLDN18-ARHGAP26融合与患者临床特征和化疗疗效相关[30,31],CLDN18.2阳性胃癌显示出更高的CD8阳性T细胞浸润[32]。然而CLDN18.2检测面临诸多挑战亟待解决,临床研究亟需CLDN18.2检测金标准,二代测序(NGS)、荧光原位杂交技术(FISH)可作为检测CLDN18.2融合的有效补充。
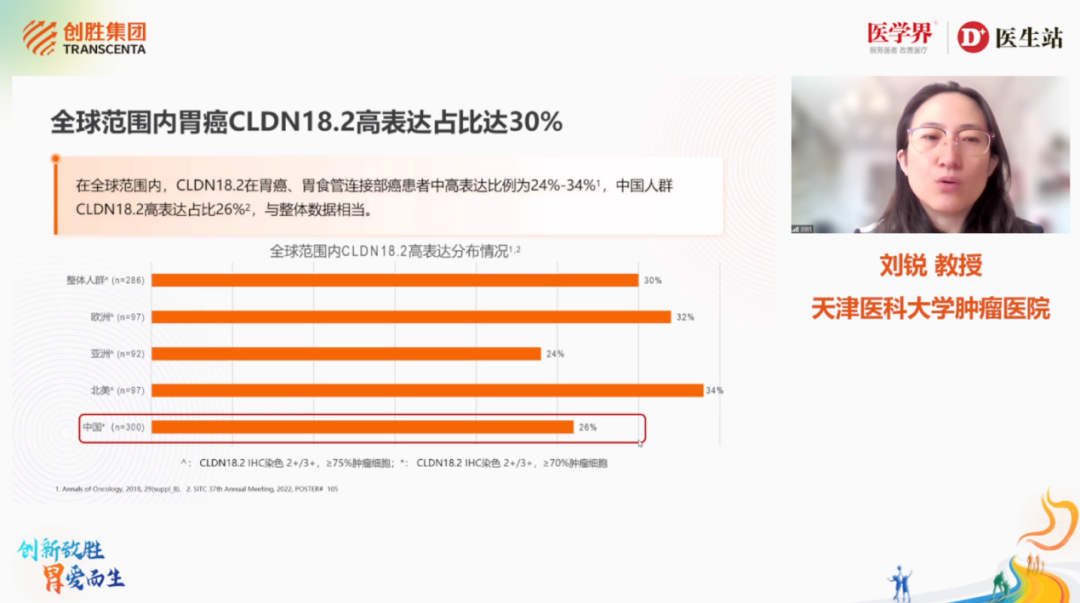
图6. 天津医科大学肿瘤医院刘锐教授
靶向CLDN18.2策略在CLDN18.2阳性晚期胃癌患者已取得一定疗效,中国医学科学院肿瘤医院孙永琨教授总结了晚期胃癌CLDN18.2研究进展,CLDN18.2作为极具前景的肿瘤靶向治疗靶点,众多创新药企争相布局,成为必争之靶点高地,目前药物开发大部分聚焦在单抗、双抗、ADC、CAR-T等领域。
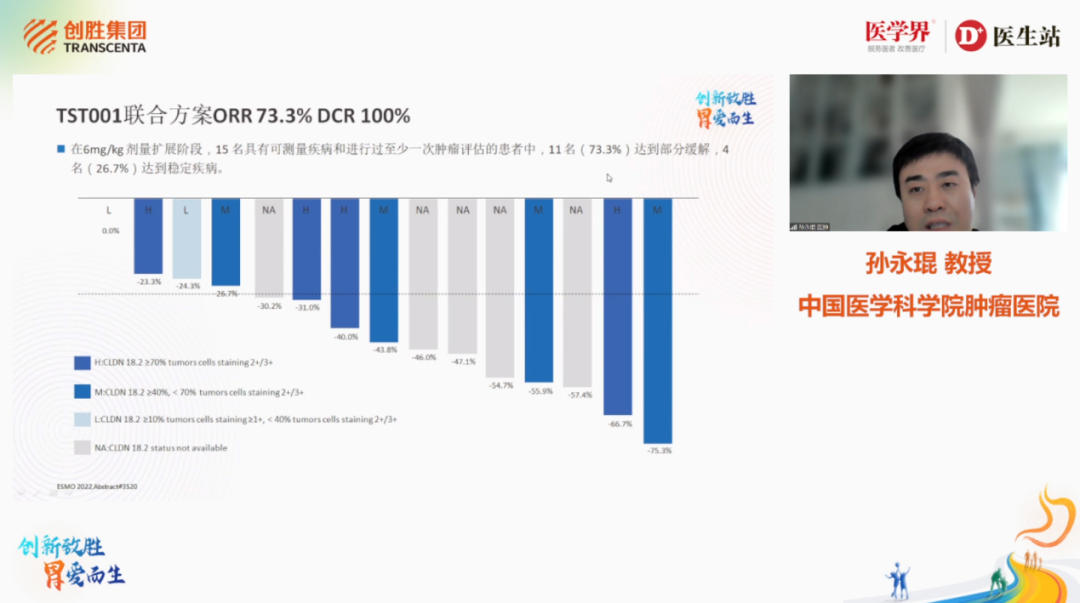
图7. 中国医学科学院肿瘤医院孙永琨教授
Zolbetuximab:FAST研究显示,Zolbetuximab一线治疗CLDN18.2高表达患者的疗效显著。在CLDN18.2表达比例≥70%的患者中,Zolbetuximab联合化疗组和单纯化疗组的中位OS分别为16.5 vs 8.9个月;在CLDN18.2表达比例≥40%的患者中,Zolbetuximab联合化疗组和单纯化疗组的中位OS分别为13.0 vs 8.3个月[33]。
TST001:通过降低 Fc 受体上的岩藻糖含量,TST001与NK细胞的结合以及抗体依赖细胞毒作用(ADCC)活性进一步增强,与 CLDN18.2 靶点亲和力更强。TST001联合方案在晚期胃癌一线早期研究中显示出可喜的疗效,ORR为73.3%,疾病控制率(DCR)为100%,剂量扩展阶段的治疗相关不良事件(TRAE)大多为 1-2 级[34]。
CAR-T:CT041在后线胃癌患者中显示较优的治疗效果,ORR为57.1%,DCR为78.6%,中位PFS为5.6个月,中位OS为10.8个月。两位患者出现了严重的TRAEs,没有患者出现剂量限制性毒性或者不良事件导致的死亡[35]。
其他:靶向CLDN18.2的双特异性抗体、ADC暂无临床数据披露。
随后,北京大学肿瘤医院刘丹教授分享了一例Ⅲc期(ypT4N3M0)胃癌患者的诊疗经过。该例患者为CLDN18.2阳性(3+/80%),错配修复基因正常(pMMR),HER2(0),PD-L1(CPS=10)。该患者术后复发,入组临床试验,接受TST001(1mg/kg)联合化疗,最佳疗效为部分缓解(PR)。

图8. 北京大学肿瘤医院刘丹教授
天津医科大学肿瘤医院刘宁教授分享了另一例CLDN18.2阳性(20%+,低表达)胃癌患者的诊疗经过,参加TST001临床研究,接受TST001 +Capox方案治疗,复查显示淋巴结较前减小,患者自觉症状明显好转,耐受性良好,无明显毒副作用。

图9. 天津医科大学肿瘤医院刘宁教授
新型靶向CLDN18.2药物表现出良好的安全性和初步的疗效,进一步的研究均在探索中。在天津医科大学肿瘤医院潘源教授的主持下,天津医科大学肿瘤医院白明教授、郑州大学第一附属医院王国俊教授和辽宁省肿瘤医院王琪玮教授针对CLDN18.2靶向治疗在胃癌一线治疗中的应用发表了各自的观点:
TST001联合CAPOX用于CLDN18.2阳性胃癌患者一线治疗,展现了良好的耐受性和令人鼓舞的抗肿瘤活性,期待继续探索TST001在胃癌及胃食管连接部癌领域与其他药物联用的潜力。
CLDN18.2是继HER2之后胃癌的重要靶点,CLDN18.2水平的界限值在不同的试验中有所不同,需要进一步研究以确定CLDN18.2水平的理想界限值,以获得最佳效益。
CLDN18.2尚无统一的检测手段、判读标准,相关的临床病理意义尚待进一步明确,需要继续积累更多的临床数据,药企、医院及有关的监管部门需要共同努力,一同制定完善的标准体系。
图10. 讨论嘉宾
大会总结
大会进入尾声,巴一教授和张小田教授对本次会议内容进行了总结。因疫情影响,部分参会嘉宾出现诸多身体不适症状,但依然克服种种困难,积极参与讨论,分享真知灼见。在此对各位带病参会的同仁表达崇敬之意,在新冠疫情复杂的时代,肿瘤科的蓬勃发展得益于迎难而上的最美逆行者们!
两位教授充分肯定了本次会议的对于晚期胃癌诊疗的推动,为致力于胃癌诊疗的同道们提供了很好的交流平台。随着靶向治疗的兴起,胃癌发生、发展分子机制研究的不断深入,CLDN18.2等众多新靶点药物的研发正在如火如荼地进行当中,为胃癌开启了全新的治疗模式,创造了新的可能性。希望在未来,能看到更多的药品研发的新突破,为广大的胃癌患者带来福音。
参考文献:
[1] Bang YJ, et al. Lancet. 2010;376(9742):687–697.
[2] Peng Z, et al. Cancer Commun (Lond). 2021;41(11):1173-1182.
[3] Gong J, et al. ESMO 2022 1210P.
[4] Shitara K, et al. Nature. 2022;603(7903):942-948.
[5] Xu. ESMO 2021. Abstr LBA53.
[6] Fuchs CS, et al. JAMA Oncol. 2018;4(5):e180013.
[7] Wilke H, et al. Lancet Oncol. 2014;15(11):1224-1235.
[8] Kang YK, et al. Lancet. 2017;390(10111):2461-2471.
[9] Li J, et al. J Clin Oncol. 2016;34(13):1448-1454.
[10] The Cancer Genome Atlas Network. Nature. 2014; 513:202-209.
[11] Bai Y, et al. J Immunother Cancer. 2022;10(3):e004080.
[12] Chao J, et al. JAMA Oncol. 2021;7(6):895-902.
[13] Ann Oncol. 2019; 30(suppl_5):v475-v532.
[14] Arienti C, Pignatta S, Tesei A. Front Oncol. 2019;9:1308.
[15] Maron SB, et al. J Clin Oncol. 2022;40(22):2458-2467.
[16] Ooki A, et al. Gastric Cancer 2021;24(6):1169-83.
[17] Catenacci DV et. 2021 ASCO, No.4010.
[18] Pellino A,et al. J Pers Med (Epub) 10-26-2021.
[19] Sahin U, et al. Ann Oncol. 2021;32(5):609-619.
[20] Shen et al, ESMO 2022, Abstract#3520.
[21] Lee, H.E, et al. Br. J. Cancer 2012, 107, 325–333.
[22] Jeeyun Lee, et al. Cancer Discov. 2019;9(10):1388-1405.
[23] Klempner et al., 2022 ESMO Abstract 1835.
[24] Zhang H, et al. Cancer Discov. 2020;10(2):288-305.
[25] Thanapprapasr D, et al. Mol Cancer Ther. 2015;14(6):1466-1475.
[26] Doi T, et al. Target Oncol. 2019;14(1):57-65.
[27] Bardia A, et al. Ann Oncol. 2021;32(6):746-756.
[28] Yang B, et al. J of Experimental Clin Cancer Research. 2019;38:138.
[29] Pellino A, et al. J Pers Med. 2021;11(11):1095.
[30] Zhang WH, et al. Front Oncol. 2020 ;10:1214.
[31] Shu Y, et al. Nat Commun. 2018 ;9(1):2447.
[32] Jia K, et al. BMC Med. 2022 ;20(1):223.
[33] Sahin U, et al. Ann Oncol. 2021 ;32(5):609-619.
[34] ESMO 2022,Abstract#3520.
[35] Shen et al, ASCO 2022, Abstract#4017.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |