*仅供医学专业人士阅读参考
揭秘HER2 IHC 3+和IHC 2+/FISH+乳腺癌患者接受抗HER2治疗的疗效是否存在差异。
人表皮生长因子受体 2(HER2) 阳性肿瘤可以定义为免疫组织化学(IHC)3+或IHC 2+且荧光原位杂交(FISH)阳性(扩增),这类患者可以从抗HER2治疗中显著获益。考虑到抗 HER2药物通过与细胞表面的HER2蛋白直接结合起作用,那么HER2蛋白表达与治疗反应之间是否存在差异,目前仍不清楚。一项研究[1]回顾性分析了行根治性手术的447例HER2阳性浸润性乳腺癌患者,结果表明IHC 2+/FISH+肿瘤患者的预后与IHC 3+肿瘤并无差异。为明确HER2阳性肿瘤按HER2表达状态分类的亚型在生物学上是否存在差异提供了新的循证证据。以下为该研究的重点内容。
HER2蛋白过表达与治疗反应的关系仍不清楚,值得进一步研究
HER2是一种受体酪氨酸蛋白激酶,由人HER2/neu基因编码。该癌基因的扩增或过表达通过诱导下游通路,如PI3K/Akt,在乳腺癌发生、发展中起着至关重要的作用[2]。抗HER2药物通过与癌细胞表面表达的HER2蛋白结合发挥作用。HER2阳性乳腺癌既往预后较差[3-4],但抗HER2靶向治疗药物显著改善了患者结局。根据美国临床肿瘤学会和美国病理学家学会 (ASCO/CAP) 指南[5],HER2阳性肿瘤定义为IHC 3+(即过表达)或FISH +(即扩增)。在临床实践中,大多数病例首先使用IHC进行评估,只有IHC评分为2+的病例,即模棱两可的病例,才会使用FISH进行HER2/neu扩增评估。通常,HER2过表达的IHC 3+肿瘤被认为具有HER2/neu扩增,其一致率约为90%[6-7]。在IHC 2+肿瘤中,约10-20%的病例FISH检测呈阳性[7-9]。虽然基于曲妥珠单抗的治疗在IHC 3+或FISH+肿瘤患者中显示获益,但不同临床试验中HER2阳性肿瘤的定义不同。在临床实践中,IHC 3+和IHC 2+/FISH+肿瘤都被视为HER2阳性乳腺癌,对于一些新的抗HER2靶向药物也是如此,如帕妥珠单抗。大量临床试验表明,IHC 3+和IHC 2+/FISH+肿瘤均能从曲妥珠单抗(单独使用或与化疗药物联合使用)中显著获益[6-7]。由于细胞表面表达的HER2蛋白相对较少,抗HER2药物对IHC 2+/FISH+肿瘤的疗效可能较差。在一项评估辅助化疗加用曲妥珠单抗治疗获益的大型随机III期临床试验(N9831,N=1888)中[10],IHC阴性且FISH(+)肿瘤患者在加用曲妥珠单抗后无病生存期无改善,而IHC 3+/FISH-肿瘤患者的无病生存期与IHC 3+/FISH+肿瘤患者相当,这表明HER2蛋白过表达对于抗HER2治疗药物发挥疗效具有关键作用。然而,IHC 3+和IHC 2+/FISH+肿瘤之间抗HER2治疗的患者结局和疗效差异尚未得到充分研究,且知之甚少。
多基因组合检测最近被引入转移性乳腺癌患者的临床实践,这些检测旨在评估肿瘤中的基因状态而不是蛋白表达,并越来越多地用于指导治疗决策。事实上,即使原发性肿瘤中HER2 蛋白表达较低,如果通过基因检测确定肿瘤为HER2阳性,也可提供抗HER2治疗。本研究目的是确定IHC 3+和IHC 2+/FISH+肿瘤之间抗HER2治疗的治疗效果和患者结局是否存在差异。研究回顾性调查了在本院治疗的HER2阳性浸润性乳腺癌患者,并重点研究IHC 3+和IHC 2+/FISH+肿瘤患者之间的差异。
研究方法
入组患者
2010年至2019年,共有447例HER2阳性浸润性乳腺癌患者在本机构接受了根治性手术。通过手术标本评估HER2状态,或者对于术前需接受新辅助化疗 (NAC) 的患者,应评估活检标本以避免化疗相关影响。手术后,根据肿瘤特征给予标准辅助治疗。在接受化疗的318例患者中,171例 (54%) 患者接受了以蒽环类药物为基础的方案,表柔比星加环磷酰胺 (EC),随后为紫杉烷类(紫杉醇或多西他赛)。另外129例 (41%) 患者仅接受EC,而18例 (6%) 仅接受紫杉烷。在接受抗HER2治疗的328例患者中,289例 (88%) 患者单独使用曲妥珠单抗,而38例 (12%) 患者同时使用帕妥珠单抗进行联合治疗。本回顾性研究纳入了因其他原因未接受全身治疗的患者,如患者拒绝,或化疗适应症不明确。
病理学评估
由两名经验丰富的病理学家进行病理学检查。根据改良的BloomRichardson组织学分级系统判断肿瘤分级。对于接受NAC的患者,病理学完全缓解 (pCR) 定义为原发性乳腺肿瘤中浸润性癌消失,即淋巴结阴性。用IHC半定量评估雌激素受体 (ER) 和孕激素受体 (PR) 状态,当&1%的肿瘤细胞核显示染色时,报告为阳性。对于Ki67标记指数,在高倍镜下在选定的热点内半定量评价核Ki67阳性的细胞。2018年,ASCO/CAP对HER2评估标准进行了轻微修订[5]。但是本研究使用了修订前标准,因为本研究病例是在2018年修订前确诊的。采用兔单克隆抗体(克隆4B5,Ventana),HER2蛋白表达被判定为0(阴性,未观察到染色,或<10%的肿瘤细胞中有膜染色)、1+(阴性,&10%的肿瘤细胞中有微弱的局灶性膜染色)、2 +(不明确,&10%的细胞膜有弱至中度染色,或≤10%的肿瘤细胞完整膜强染色),和3+(阳性,&10%的肿瘤细胞完整膜强染色)。2010年至2012年(含)确诊的患者,根据当时的ASCO/CAP指南[11],使用30%作为3+临界值。使用PathVysion HER2 DNA探针试剂盒 (Abbott Japan,Tokyo,Japan) 进行FISH检测。HER2/neu基因扩增定义为FISH比值&2.0。在极少数情况下,NAC治疗后IHC 显示一些肿瘤从HER2阴性转变为HER2阳性(例如,IHC 1+至3+),将这些病例从本研究中排除。
研究结果
HER2阳性肿瘤患者的特点
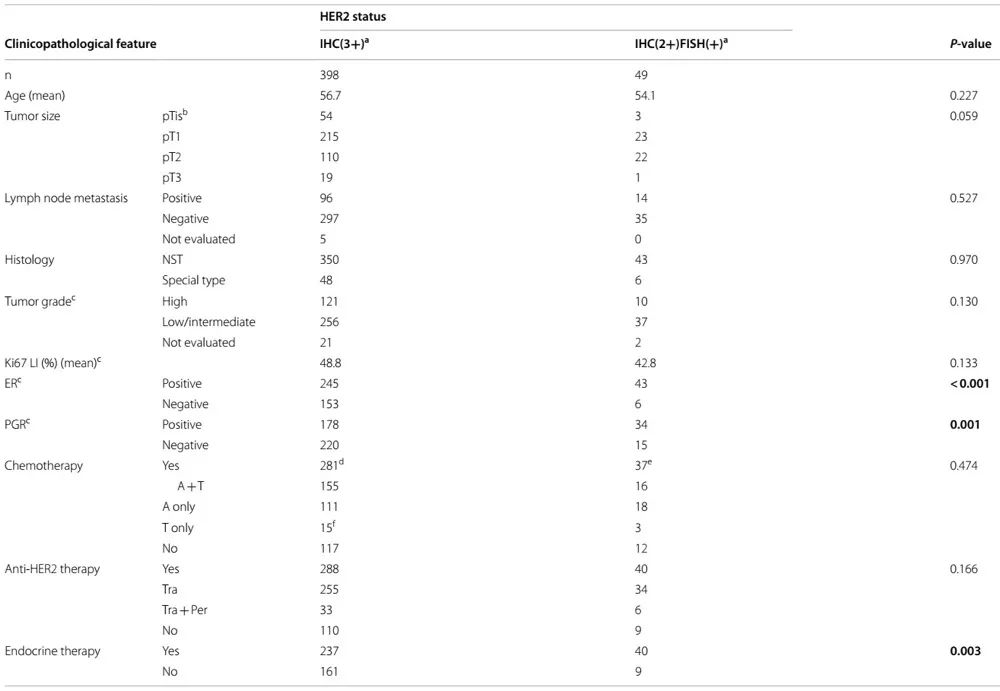
共入组447例患者,其中IHC 3+和IHC 2+/FISH+肿瘤患者分别为398例 (89%) 和49例 (11%)。在所有447例患者中,134例接受NAC。共有318例患者接受了辅助化疗,54%接受了以蒽环类药物为基础的治疗方案,随后接受了紫杉烷治疗,41%仅接受了以蒽环类药物为基础的治疗方案,6%仅接受了紫杉烷治疗。同时给予抗HER2靶向药物,共持续1年。然而,在一些NAC病例中,患者在术后才开始使用曲妥珠单抗,因为当时该药物刚刚在日本获批用于NAC(2010年)。12%接受抗HER2靶向药物的患者同时给予帕妥珠单抗和曲妥珠单抗。根据月经情况给予激素受体 (HR) 阳性肿瘤患者内分泌治疗。研究根据HER2状态进一步分析了这些数据(表1)。在IHC 2+/FISH+组中,观察到显著更多的ER和PR肿瘤(分别为P<0.001和P=0.001),而在肿瘤分级和给予化疗等其他因素之间未发现差异。考虑到HR状态,给予更多IHC 2+/FISH+肿瘤患者辅助内分泌治疗 (P=0.003)
表1. 根据HER2状态的临床病理学特征(n=447)
与NAC相关的临床病理学因素
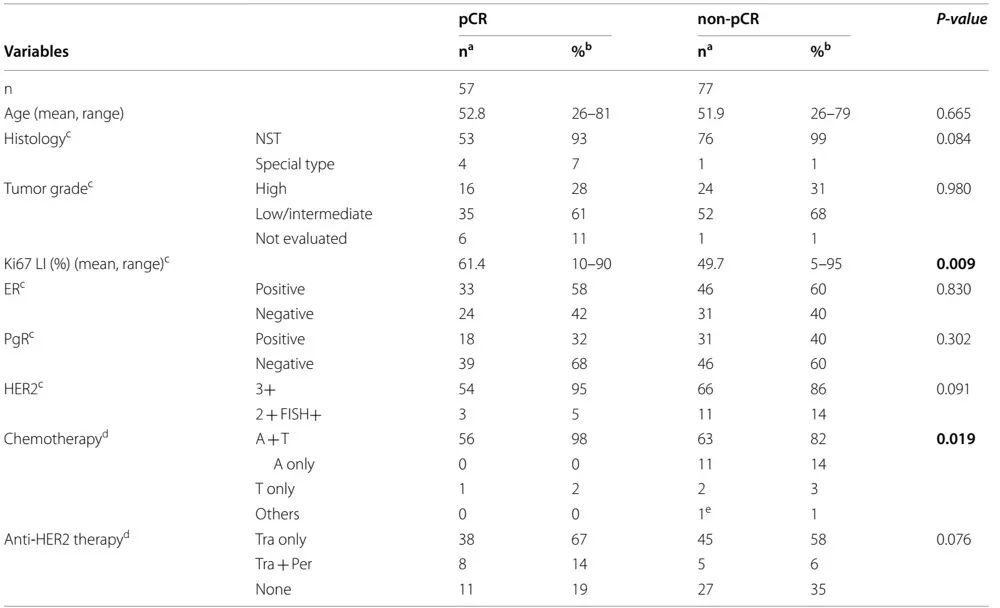
在134例接受NAC的患者中,57例患者获得pCR。根据化疗效果(是否获得pCR)分层的134例患者的临床病理特征见表2。pCR组表现出较高的Ki67标记指数(P=0.009)。在pCR组中观察到显著更多的接受蒽环类药物和紫杉烷联合治疗作为化疗的患者(P=0.019)。按ER状态分层时,未观察到pCR率差异。IHC 3+和IHC2+/FISH+肿瘤的pCR率分别为45%(120例中的54例)和21%(14例中的3例),但无统计学差异 (P=0.091)。
表2.新辅助化疗病例的临床病理学特征 (n=134)
与患者结局相关的因素
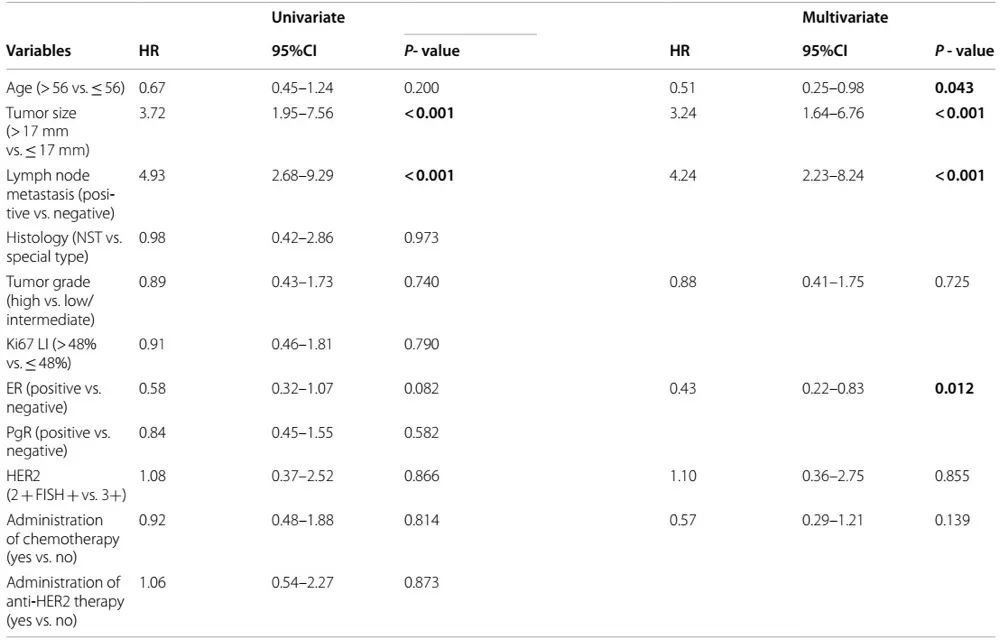
在平均59个月 (1-137) 的观察期内,42例患者发生远处转移(447例中的9.4%)。因乳腺癌死亡14例 (3.1%)。单变量分析显示病理性肿瘤大小和淋巴结受累与无病生存期相关(DFS;表3)。用多因素分析,年龄、肿瘤大小、淋巴结状态和ER是DFS的独立影响因素(分别为P=0.043、P < 0.001、P < 0.001和P=0.012)。换句话说,年轻、肿瘤较大、有淋巴结转移和(或)ER阴性的患者DFS明显缩短。IHC 3+与IHC 2+/FISH+肿瘤无差异。
表3. 与无病生存期相关的临床病理学特征 (n=447)
然后根据全身治疗采用Kaplan-Meier分析评估IHC 3+和IHC 2+/FISH+肿瘤之间患者结局的差异。在评价所有参与者时,IHC 3+和IHC 2+/FISH+肿瘤患者的DFS或乳腺癌相关总生存期 (OS) 没有差异(n=447;图1A 和图1B)。
同样,在接受化疗和抗HER2药物联合作为标准辅助治疗的患者中,IHC 3+和IHC 2+/FISH+肿瘤患者的DFS或乳腺癌相关OS没有差异,与术前/术后是否给药无关(n=314;图1C和图1D),或未接受任何化疗的患者(n=129;图1E 和图1F)。4例因某种原因接受辅助化疗但未接受抗HER2药物的患者被排除在分析之外,如图1 C和图1D所示。亚组分析比较了133例接受NAC患者的DFS,同样发现IHC 3+和IHC 2+/FISH+肿瘤患者的DFS无差异(P=0.821)。
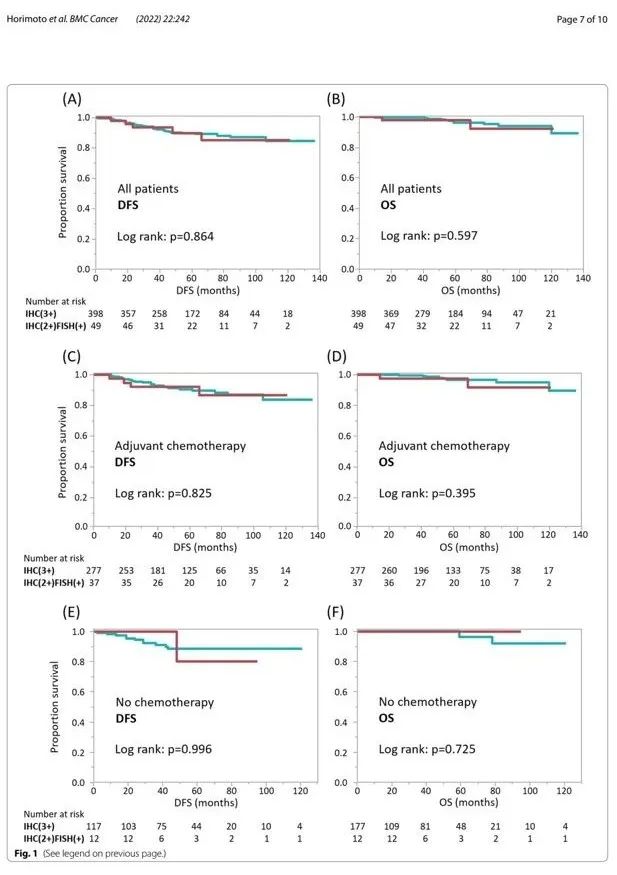
图1. 按HER2状态分层的患者结局。A-B Kaplan-Meier分析表明,根据HER2状态,所有447例患者的无病生存期 (DFS)(A) 和乳腺癌相关总生存期 (OS)(B)。绿线和红线分别表示IHC 3+和IHC 2+/FISH+肿瘤患者。314例接受辅助化疗联合抗HER2药物的患者的DFS(C)和OS(D)。129例未接受任何化疗的患者的DFS(E) 和OS(F)
按HR状态分层后单独分析患者结局。主要结果没有改变,因为IHC 2+/FISH+和IHC 3+肿瘤在按照HR阳性和HR阴性肿瘤分层后,所有患者或接受辅助化疗的患者的DFS或OS 没有显著差异。而在HR阴性肿瘤患者中,IHC 2+/FISH+肿瘤的OS明显短于IHC 3+肿瘤。但是IHC 2+/FISH+组的样本量 (n=4) 较小意味着该结果的显著性尚无定论。最后,研究分析了47例发生远处转移的患者在转移后的生存期(图2)。IHC 3+组 (n=37) 的平均生存期为32个月(范围,0-1184),而IHC 2+/FISH+组 (n=5) 的生存期显著缩短(平均,9个月;范围,3-22;P=0.018),尽管该组的患者数量明显较少。
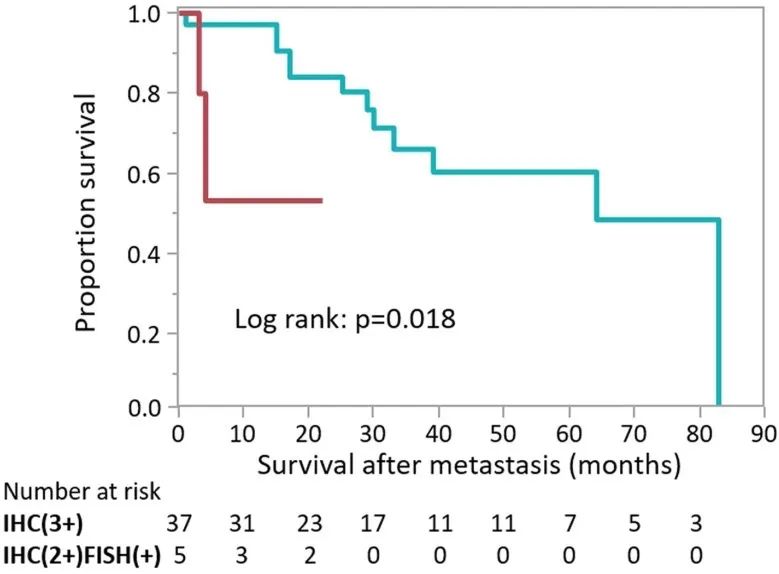
图2. 发生远处转移后的生存期,按HER2状态分层 (n=42)。Kaplan-Meier分析表明发生远处转移后的生存期。绿线和红线分别表示IHC 3+和IHC 2+/FISH+肿瘤患者
总结
综上所述,本研究结果表明年龄、肿瘤大小、淋巴结状态和ER状态是与无病生存期相关的独立因素,但IHC 3+和IHC 2+/FISH+肿瘤之间未见差异。Kaplan-Meier分析发现,即使分层为接受过 (n=314) 或未接受过 (n=129) 抗HER2药物化疗的患者,患者结局也无差异。在134例接受NAC的患者中,IHC 3+和IHC 2+/FISH+肿瘤的pCR率分别为45%和21%,但无统计学差异。这些数据提示IHC 2+/FISH+肿瘤患者的预后与IHC 3+肿瘤患者并无差异。由此说明HER2蛋白过表达水平与抗HER2治疗应答的相关性仍不清楚,进一步的研究对于为患者提供更个性化的治疗策略至关重要。
参考文献
1. Horimoto Y, Ishizuka Y, Ueki Y, et al. Comparison of tumors with HER2 overexpression versus HER2 amplification in HER2-positive breast cancer patients. BMC Cancer. 2022 Mar 5;22(1):242.
2. Burstein HJ. The distinctive nature of HER2-positive breast cancers. N Engl J Med. 2005;353:1652–4.
3. Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science. 1987;235:177–82.
4. Seshadri R, Firgaira FA, Horsfall DJ, et al. Clinical significance of HER-2/neu oncogene amplification in primary breast cancer. The South Australian Breast Cancer Study Group. J Clin Oncol. 1993;11:1936–42.
5. Wolff AC, Hammond MEH, Allison KH, et al. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. J Clin Oncol. 2018;36:2105–22.
6. Vogel CL, Cobleigh MA, Tripathy D, Gutheil JC, Harris LN, Fehrenbacher
L, Slamon DJ, Murphy M, Novotny WF, Burchmore M, Shak S, Stewart SJ,
Press M. Efficacy and safety of trastuzumab as a single agent in first-line
treatment of HER2-overexpressing metastatic breast cancer. J Clin Oncol.
2002;20:719–26.
7. Baselga J. Herceptin alone or in combination with chemotherapy in the treatment of HER2-positive metastatic breast cancer: pivotal trials. Oncology. 2001;61(Suppl 2):14–21.
8. Dybdal N, Leiberman G, Anderson S, et al. Determination of HER2 gene amplification by fluorescence in situ hybridization and concordance with the clinical trials immunohistochemical assay in women with metastatic breast cancer evaluated for treatment with trastuzumab. Breast Cancer Res Treat. 2005;93:3–11.
9. Horimoto Y, Terao T, Tsutsumi Y, et al. Estrogen Receptor-positive Ductal Carcinoma In Situ Frequently Overexpresses HER2 Protein Without Gene Amplification. Am J Surg Pathol. 2019;43:1221–8.
10. Perez EA, Reinholz MM, Hillman DW, et al. HER2 and chromosome 17 effect on patient outcome in the N9831 adjuvant trastuzumab trial. J Clin Oncol. 2010;28:4307–15.
11. Wolff AC, Hammond MEH, Schwartz JN, et al. American Society of Clinical Oncology/College of American Pathologists Guideline Recommendations for Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer. J Clin Oncol. 2007;25:118–45.
审批号:CN-105957
过期日期:2023-12-18
* 本文由阿斯利康提供支持,仅供医疗专业人士参考
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |