
#结直肠癌#(colorectal cancer, CRC)是最常见的消化系统恶性肿瘤之一。近年来随着生活水平的提高,结直肠癌发病率及致死率一直呈稳定增长的趋势。5-氟尿嘧啶(5-FU)作为结直肠癌治疗中的一线药物,主要通过抑制胸苷酸合成酶发挥作用。然而最终患者大多都会产生耐药导致复发。因此,急需找出新的分子机制,为防治结直肠癌复发提供新思路。
COP9信号体 (CSN) 包含8个不同大小的核心亚基,参与多种生理过程,如泛素化降解、细胞周期、信号转导、DNA损伤和肿瘤发生等【1】。研究表明,CSN6在不同类型的癌症中高表达,并在蛋白酶体降解中发挥重要作用【2】。该组研究人员前期发现CSN6在结直肠癌中高表达并促进catenin的稳定,影响肠癌发生发展(Cancer Cell 2015, Adv Sci 2020)【3, 4】。由于CSN6全敲除小鼠具有胚胎致死性,因此大多数研究都是基于细胞系进行的。最近,心脏特异性Csn6诱导敲除 (Csn6-iko) 小鼠首次被构建并用于致心律失常性右室发育不良的研究【5】。然而CSN6在体内对癌症进展的作用尚不清楚。
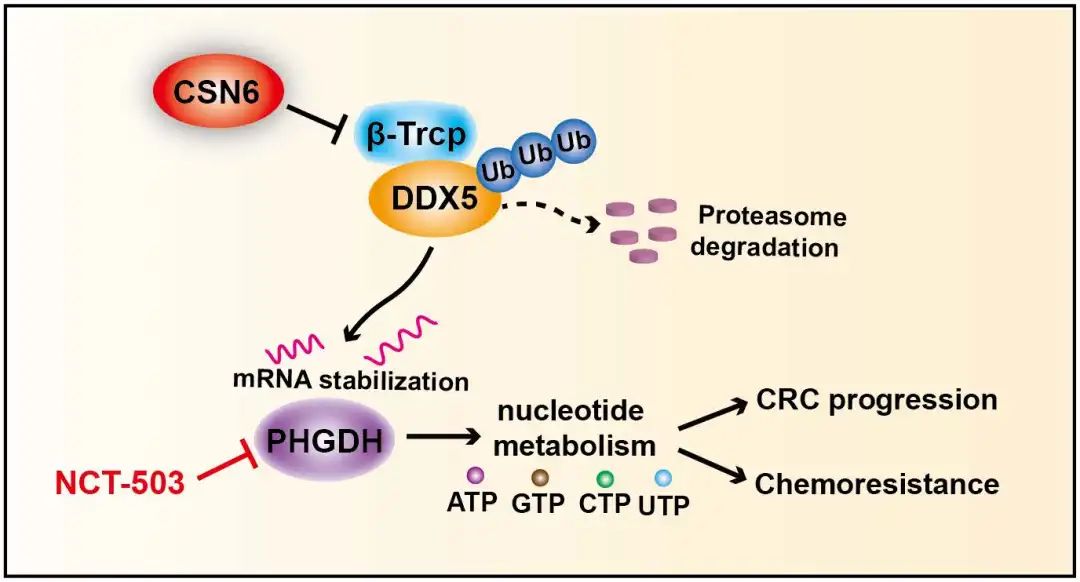
近日,中山大学附属第六医院方乐堃、李孟鸿、兰平团队合作,在Cancer Research发表题为CSN6 mediates nucleotide metabolism to promote tumor development and chemoresistance in colorectal cancer的研究成果。该研究阐明了CSN6可泛素化调控DDX5-PHGDH轴从而影响核苷酸合成,最终诱导结直肠癌的发生发展和耐药,为改善结直肠癌的治疗提供了潜在的治疗靶点。

研究人员通过生信分析结直肠癌患者标本揭示了CSN6表达与嘌呤和嘧啶代谢之间的相关性。首次构建CSN6条件性敲除鼠并基于AOM/DSS建立肠癌模型。随后,从细胞、裸鼠及敲除鼠3个层面分别证实结直肠癌中CSN6表达降低明显抑制核苷酸合成。同时,体内外实验证实敲低CSN6可增强5-FU化学敏感性,且可通过补充核苷部分逆转。碳13标记的葡萄糖结合LC-MS技术进一步深入分析敲低CSN6 对体内外核苷酸(嘌呤及嘧啶)代谢流的影响。结果提示沉默CSN6能显著减少丝氨酸和甘氨酸的合成总量,且能明显抑制葡萄糖进入丝氨酸和甘氨酸代谢流,最终导致肌苷一磷酸合成明显减少。同时,敲低CSN6导致氨甲酰天冬氨酸及二氢乳清酸合成明显减少,最终抑制葡萄糖提供碳给尿苷一磷酸合成。
机制上,通过一系列补救实验揭示CSN6通过上调PHGDH的表达调控核苷酸合成,促进结直肠癌进展。质谱鉴定提示RNA结合蛋白DDX5是CSN6潜在结合蛋白。CSN6通过抑制β-trcp介导的DDX5泛素化降解,进而提高PHGDH mRNA稳定性,最终促进核苷酸合成和CRC进展。组织芯片实验评估CSN6、DDX5和PHGDH 的临床相关性。与其他组相比,高CSN6 和PHGDH、高CSN6和DDX5、高DDX5 和PHGDH均导致差的总生存率。丁酸,作为肠道菌群代谢物之一,可降低CSN6表达,提高5-FU化疗疗效,为结直肠癌临床治疗提供新思路。
中山大学附属第六医院方乐堃研究员、李孟鸿教授和兰平教授为论文的共同通讯作者,邹邵敏博士后为论文的第一作者。
原文链接:
https://aacrjournals.org/cancerres/article-abstract/doi/10.1158/0008-5472.CAN-22-2145/711647/CSN6-mediates-nucleotide-metabolism-to-promote?redirectedFrom=fulltext
方乐堃课题组长期招聘博士后
方乐堃,中山大学附属第六医院研究员,博士生导师,国家优秀青年基金获得者,广东省特支计划青年拔尖人才。主要从事消化道疾病代谢调控及干预研究,近年来以中山大学作为通讯单位,作为通讯作者(含共同)成果发表在Cell Research、Science Translational Medicine、Cancer Research、J Am Chem SOC和Advanced Science等高水平期刊上。主持国家自然科学基金4项,国家重点研发项目课题1项。作为完成人获得2016年国家科技进步二等奖和2020年教育部科学技术进步一等奖。实验室主要研究方向为消化道疾病代谢通路调控及干预:1)结直肠代谢调控;2)结直肠癌泛素化调控;3)肠癌并发症放射性肠炎发病机制。
现因工作需要,诚聘博士后 2名,提供国内具有竞争力的薪酬,博士后基本年薪:32-35万+科研绩效奖励。
简历投递(有意者请将个人简历等材料发至):
https://jinshuju.net/f/ZqXwZt
参考文献
1. Zhang, H., et al., The crystal structure of the MPN domain from the COP9 signalosome subunit CSN6. FEBS Lett, 2012. 586(8): p. 1147-53.
2. Chen, J., et al., CSN6 drives carcinogenesis by positively regulating Myc stability. Nat Commun, 2014. 5: p. 5384.
3. Fang, L., et al., ERK2-Dependent Phosphorylation of CSN6 Is Critical in Colorectal Cancer Development. Cancer Cell, 2015. 28(2): p. 183-197.
4. Choi, H.H., et al., EGF Relays Signals to COP1 and Facilitates FOXO4 Degradation to Promote Tumorigenesis. Adv Sci (Weinh), 2020. 7(20): p. 2000681.
5. Liang, Y., et al., Desmosomal COP9 regulates proteome degradation in arrhythmogenic right ventricular dysplasia/cardiomyopathy. J Clin Invest, 2021.


想了解更多精彩内容,快来关注BioArt生物艺术
| 留言与评论(共有 0 条评论) “” |