*仅供医学专业人士阅读参考
相较于常见的肺癌、胃癌等肿瘤,神经内分泌肿瘤(NEN)直到上个世纪末才作为一种独立的疾病被广大临床医生所认知。临床医生和病理医生在摸索中不断前行,以期为NEN的患者带来更好更有效的治疗方案。国内随着近年来对NEN的重视,临床诊疗水平不断提高,面对多个不同机制的药物,临床专家需要根据不同药物的药理特性,结合临床研究数据的分析,对中国患者作出合理的推荐,以期制订适合国人的用药共识。基于此,“医学界”特邀请解放军总医院第一医学中心的徐建明教授为我们剖析NEN临床治疗的合理药物选择。
他山之石:NEN临床诊疗中长效奥曲肽三期临床PROMID研究所带来的思考
自从上个世纪七十年代生长抑素被发现以来,围绕该激素以及相关机制的科学研究就一直热度不低。经过不断的探索,生物学家们已经发现了生长抑素以下的生理作用:抑制生长激素、甲状腺刺激激素、胰岛素和胰高血糖素的分泌,并抑制胃酸的分泌,还可影响胃肠道的吸收、动力、内脏血流和营养功能[1]。
奥曲肽这个化学名可能是生长抑素类药物中,国内专家相对比较熟悉的一种。由于国外神经内分泌肿瘤的概念提出较早,奥曲肽在其药理作用明确之后很快就受到了临床专家的关注。受限于当时的研发能力,除了化疗药物和生长抑素外并没有更多的药物可供临床用来治疗神经内分泌肿瘤,奥曲肽也于上个世纪八十年代末期获批用于胃肠胰神经内分泌肿瘤。
普通奥曲肽在临床治疗中使用较为不便,在治疗期间患者需要每日皮下注射多次,对患者的依从性要求高。长效奥曲肽剂型的研发就是本着增加患者依从性,改善治疗体验的初衷开展的。
因此,2001年到2008年在德国启动了名为”PROMID”的长效奥曲肽Ⅲ期临床研究。该实验(NCT00171873)的总体设计为随机、双盲的安慰剂对照研究。该研究的入排标准如下:未曾治疗的患者;经组织病理学证实;局部不能手术切除或转移性的高分化肿瘤;功能活跃或不活跃的神经内分泌肿瘤/癌;原发肿瘤病灶位于中肠或原发不明但支持起源于中肠,排除原发病灶位于胰腺、胸部或其他部位者。入组患者被1:1随机分配到治疗组和对照组,治疗组采用每28天肌肉注射长效奥曲肽30mg的方案,对照组使用安慰剂,直至患者肿瘤进展或死亡。研究的主要终点是TTP(至肿瘤进展或至肿瘤相关性死亡时间时间),次要终点包括肿瘤应答、生存时间和患者的生活质量[2]。
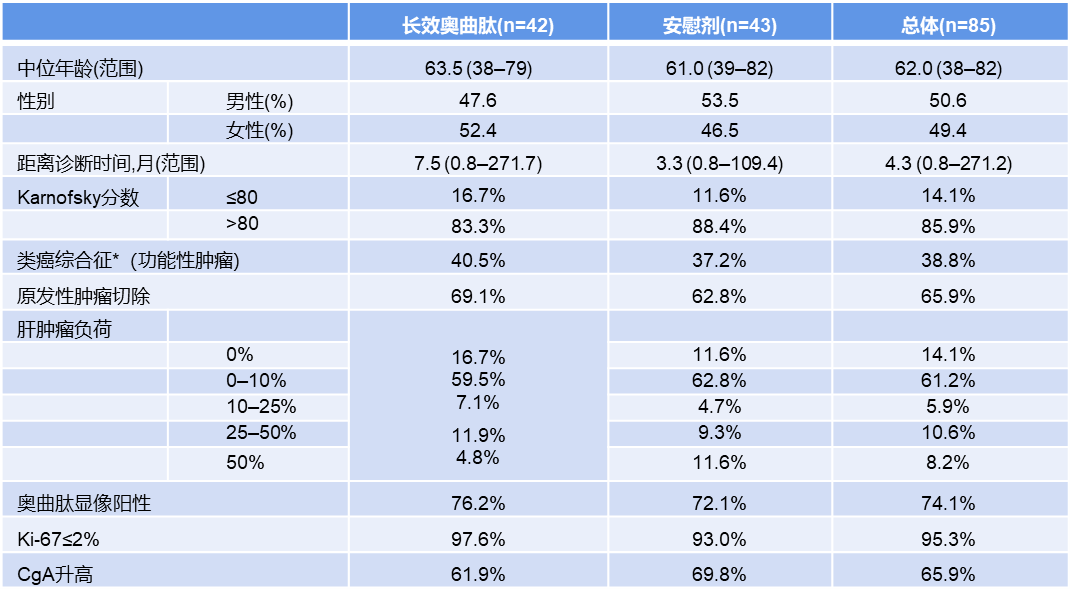
入组患者绝大部分的患者体征情况较好,有83.3%的受试患者Karnofsky评分大于80,且大部分患者肝脏肿瘤负荷较轻(0和0-10%肝肿瘤负荷患者占总受试患者的76.2%),奥曲肽显像阳性的患者占比为76.2%,而其中Ki-67指数小于2%(临床界定的G1)的患者高达97.6%。根据患者的基线特征,我们不难发现PROMID研究的入组人群和国内临床工作中患者的真实情况存在很大的差异。以日耳曼人种为主的德国患者的流行病学特征是G1期患者占比更高,而我国人群的流调数据来看,反而是G2人群占比超过四成[3]。除此之外,从研究披露的数据来看,PROMID研究在入组人群中生长抑素受体表达阳性的患者高达76.2%,而国内人群的SSTR阳性表达在六成左右,存在一定的差异。另外必须关注到的是,PROMID研究入组人群是原发肿瘤病灶位于中肠或原发不明但支持起源于中肠,排除了原发病灶位于胰腺、胸部或其他部位者(表1)。从组织学和胚胎起源学来看[4],国内发病率更高的胃和胰都归为前肠,直肠则是属于后肠,明确可为中肠来源的患者占比只有7%左右[5]。
表1
这提示我们不同人种的患者存在明显的特征差异。对某个特定类型患者能够收获疗效的药物,在特征不同的患者群体中并不一定能有明确的获益。对于国内Ki-67指数、恶性程度普遍更高的人群,严格来说,长效奥曲肽的临床疗效证据是缺乏的。
另外一个同样值得思考的问题是长效奥曲肽对于肿瘤负荷不同患者的获益。从实验披露的数据来看,长效奥曲肽组的中位TTP为14.3个月,安慰剂组中位TTP为6.0个月,P=0.000072,确实观察到明显的临床获益。但是随着肿瘤负荷的增高,肝脏肿瘤负荷>10%的亚组患者,长效奥曲肽组TTP为10.35个月,安慰剂组为4.48月,p=0.1381[6],说明对于肿瘤负荷较高的患者,SSA类药物的临床获益缺乏系统性验证。
国之璞玉:索凡替尼三期研究SANET-P/SANET-EP打开国内神经内分泌肿瘤临床治疗新局面
正是因为当时国内的神经内分泌肿瘤患者缺乏针对性的药物,一个真正以国内患者作为受试人群的临床实验所验证的药物——“索凡替尼”显得弥足珍贵。
该研究立项之初,即充分考虑到了当时国内神经内分泌肿瘤的临床现状,区分了以胰腺患者为主要来源的SANET-P和非胰腺患者为主要来源的SANET-EP两个独立的研究。
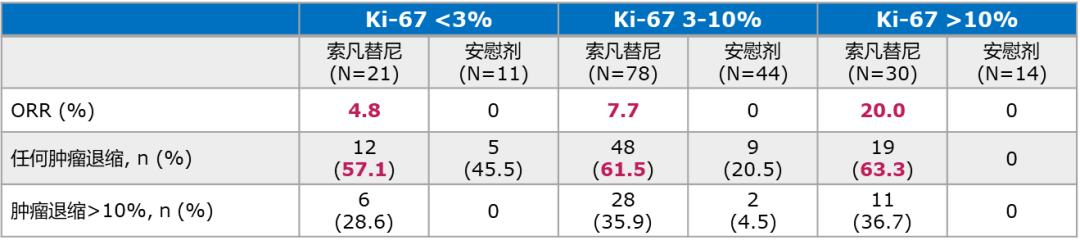
其中SANET-P研究将进展或晚期的胰腺神经内分泌肿瘤患者作为入组人群,按照2:1随机分成实验组(索凡替尼300mg QD)与对照组(安慰剂),以研究者评估的PFS为主要终点,ORR、DCR、DOR、TTR、OS以及安全性和耐受性作为次要终点。最终的实验组中病理分级为G1/G2的分别占12.4%和87.6%,95.6%的患者伴有不同程度的肝转移。最终的数据分析中,主要终点mPFS上取得了显著的统计学差异(实验组10.9M VS对照组3.7M p=0.0011)(图1),客观缓解率(ORR)上也取得了令人鼓舞的成果(实验组19.6% VS对照组2% p=0.0021)。同时在亚组分析中,索凡替尼在大部分的亚组中均观察到PFS的获益(图2),基于Ki-67的亚组分析中,不同表达水平的亚组患者的ORR和PFS均有获益[7]。(表1)
安全性方面,最常见的TEAEs是高血压、蛋白尿和腹泻,但是可防可控,对于患者的生活质量影响较小。

图1
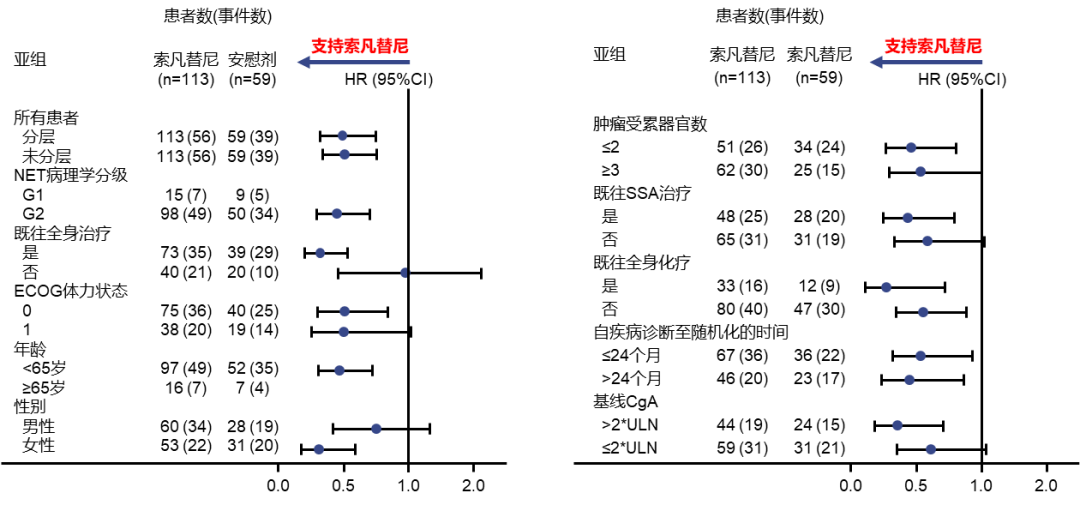
图2
表2

在同期进行的SANET-EP研究中,纳入198例非胰腺来源神经内分泌肿瘤受试人群,随机按照2:1分成实验组(索凡替尼300mg QD)和对照组(安慰剂)。入组患者的原发肿瘤起源包括前肠(呼吸道、胸腺、食管、胃、 肝、胆囊)、中肠(小肠、盲肠、阑尾)和后肠(结肠、直肠)、除上述以外其他部位来源,以及原发灶不明的患者,以研究者评估的PFS为主要终点,ORR、DCR、DOR、TTR、OS以及安全性和耐受性作为次要终点。最终实验组中病理分级为G1/G2的分别占16.3%和83.7%,75.2%的患者伴有不同程度的肝转移。
在最终的数据分析中,主要终点mPFS同样取得了显著的统计学差异(实验组9.2M VS对照组3.8M p<0.0001)(图3)。同时在基于Ki-67的亚组分析中,不同表达水平下的亚组患者中的肿瘤退缩均有获益[8]。(表3)。
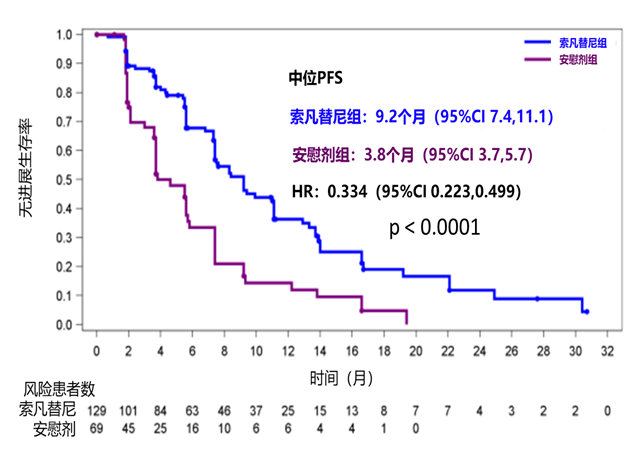
图3
表3
去芜存菁:索凡替尼上市惠及更多神经内分泌肿瘤患者
在之前的很长一段时间里,国内针对神经内分泌肿瘤的药物研发都处于空白状态,医生面临着可选择的药物不足、治疗方案有限的局面。加之与西方国家相比,中国患者特征不同,SSA类药物用于Ki-67的≥10%、SSTR(-)、肿瘤负荷≥10%、一年内肿瘤进展的患者往往不能收获令人满意的疗效。随着索凡替尼两个三期临床研究的完成并成功获批,其不仅对中肠来源的患者收获显著疗效,其他部位的入组人群同样观察到临床获益,满足了上述人群的治疗需求。在2022年1月成功纳入了国家医保目录后,相信更多的神经内分泌肿瘤患者可以从索凡替尼的治疗方案中获益,收获更好的预后。
专家简介

徐建明 教授
解放军总医院第一医学中心肿瘤中心主任,教授,博士生导师
中国抗癌协会大数据与真实世界专业委员会 副主任委员
中国研究型医院 肿瘤学专业委员会 副主任委员
中国临床肿瘤学会胃肠胰腺神经内分泌肿瘤专业委员会 前主任委员
参考资料:
[1].《中国药典》2020年版2部
[2].Rinke A, et al. J Clin Oncol. 2009 Oct 1;27(28):4656-63.
[3].Dasari, Arvind; Shen, Chan; Halperin, Daniel; Zhao, Bo; Zhou, Shouhao; Xu, Ying; Shih, Tina; Yao, James C. (2017). Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States. JAMA Oncology
[4].石玉秀. 组织学与胚胎学 [M]. 人民卫生出版社, 2007.
[5].Fan JH, et al. Oncotarget. 2017 May 3;8(42):71699-71708
[6].Arnold R et al. Presented at: ASCO 2009 Annual Meeting; May 29-June 2, 2009; Orlando, FL. Abstract 4508.
[7].Xu J, et al. Lancet Oncol. 2020 Nov;21(11):1489-1499.
[8].Zhou Z, et al. 2020 ESMO Abstract 4261.
P-STD-22N111-Valid Until 2024 Dec
本资料旨在促进医药信息的沟通和交流。本资料仅供医疗卫生专业人士作学术参考,而非针对一般公众,亦非广告宣传。处方请参考国家药品监督管理局批准的药品说明书。本资料请勿分发或转发。
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |