*仅供医学专业人士阅读参考
CAPSTONE-1研究mOS达15.3个月,SCLC患者再续生命新篇章。
近年来,随着免疫治疗在肺癌领域的不断探索,小细胞肺癌(SCLC)的治疗也迎来了新的机遇。IMpower133研究和CASPIAN研究将SCLC的治疗带入了免疫治疗新时代,一举打破广泛期小细胞肺癌(ES-SCLC)中位总生存期(mOS)多年来难以突破10个月的窘境,对于疾病进展速度较快、预后较差的SCLC来说,治疗现状仍然不尽人意,新药的研发脚步也从未停止。2022年5月,阿得贝利单抗作为我国首个原研创新一线治疗ES-SCLC的PD-L1抑制剂,其III期临床CAPSTONE-1研究结果发表于《柳叶刀·肿瘤学》,研究结果表明阿得贝利单抗联合化疗方案治疗一线ES-SCLC的mOS达15.3个月[1]。借此,“医学界”特别邀请到解放军第960医院王宝成教授就CAPSTONE-1研究结果为我们分享SCLC免疫治疗的相关进展。
破冰之旅,阿得贝利单抗再创PD-L1一线治疗mOS新高
肺癌是全球范围内发病率和死亡率位居前列的恶性肿瘤[2],尤其是SCLC的预后令人堪忧。王宝成教授就SCLC的治疗现状为我们进行深入浅出的阐述:“SCLC占肺癌的15%-20%,相对于肺鳞癌、腺癌等其他病理类型,SCLC侵袭性高、生长迅速,易发生转移。SCLC分为局限期和广泛期,临床上大多患者就诊时已为广泛期,失去手术机会。长期以来,ES-SCLC的治疗以卡铂、顺铂联合依托泊苷的化疗治疗方案为主,但收效甚微。而切换不同方案化疗、化疗联合放疗或靶向治疗等治疗方式,始终未能突破10个月的mOS瓶颈。直至近年来,以免疫检查点抑制剂(ICI)在ES-SCLC取得了一定进展。基于IMpower133研究和CASPIAN研究这两项研究结果,阿替利珠单抗和度伐利尤单抗先后被FDA获批用于ES-SCLC一线治疗,部分患者从中获益。”
目前,这两款进口PD-L1抑制剂已在国内获批用于一线治疗ES-SCLC,王宝成教授表示:“进口PD-L1抑制剂的价格高昂,且尚未纳入医保,对于我国大多SCLC患者的家庭经济负担难以承受,临床使用存在诸多局限性。目前,我国自主原研创新的PD-L1抑制剂阿得贝利单抗Ⅲ期注册研究已取得阳性结果,或将改写中国SCLC治疗格局。CAPSTONE-1研究是阿得贝利单抗联合化疗一线治疗ES-SCLC的全国多中心随机、对照Ⅲ期临床研究,其主要研究终点mOS达到15.3个月。据悉,国家药品监督管理局(NMPA)已经受理阿得贝利单抗一线治疗ES-SCLC的上市申请。作为我国首个自主研发一线治疗ES-SCLC的PD-L1抑制剂,阿得贝利单抗在给患者带来生存获益的同时,期待恒瑞医药能更多参考我国药物经济学现状,给予患者更具性价比的价格,以增强免疫药物的可及性,让更多SCLC患者用上好药。此外,TIGIT、LAG-3等新型免疫抑制剂也是近年临床研究探索热点方向,希望能提升SCLC患者免疫治疗的生存获益。”
履践致远,CAPSTONE-1研究影响中国SCLC治疗格局
王宝成教授对于CAPSTONE-1研究进行简要解读,在研究设计上,首先,研究纳入人群100%为中国患者,更符合中国临床实践,对于中国SCLC患者更具指导意义与价值。其次,研究者选择随机、双盲试验,2年的免疫治疗时间设计更加符合临床诊疗实际。过程中探索了免疫治疗的最佳维持时间,对于免疫治疗中所展现出的“超长待机现象”或称之为“长拖尾效应”的观察更加充分及完整。”
对于研究结果,王宝成教授指出:“CAPSTONE-1研究于2022年在美国癌症研究协会(AACR)年会中首次公布结果,而后登上国际肿瘤学顶级期刊《Lancet Oncology》,其mOS再次刷新了PD-L1抑制剂在ES-SCLC的生存数据。研究结果显示,阿得贝利单抗抗联合化疗一线治疗ES-SCLC的mOS达15.3个月,显著降低死亡风险28%。值得注意的是,其2年生存率达31.3%,是对照组的近2倍,这一数据说明阿得贝利单抗让更多患者有机会达到2年的生存时间。CAPSTONE-1研究结果证明了阿得贝利单抗联合化疗为中国ES-SCLC患者带来了长生存获益,也必将对我国SCLC的治疗格局产生重大影响。”
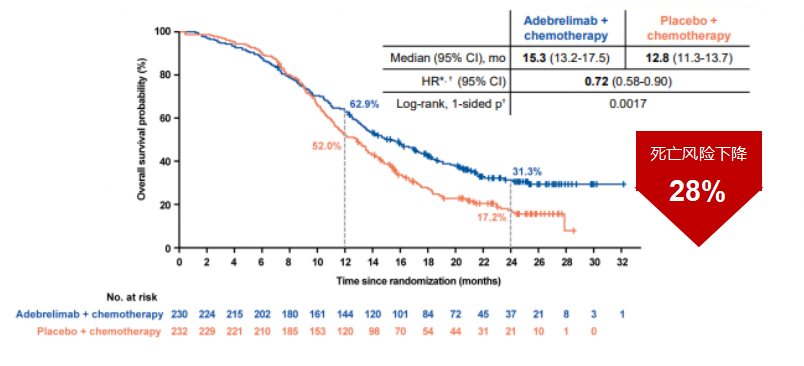
图1 主要研究终点OS生存曲线图
统筹兼顾,阿得贝利单抗平衡免疫治疗疗效与安全性
免疫治疗像是一把双刃剑,为ES-SCLC患者带来长期生存的同时,也要关注其相关不良反应。王宝成教授将疗效与安全性比喻成一部马车的两个车轮,在患者治疗过程中,两者缺一不可:“免疫治疗不良反应(irAE)的处理是临床医生关注的重点之一,安全性问题不容小觑。在CAPSTONE-1研究中,阿得贝利单抗联合化疗治疗组的irAE率仅为27.8%,主要是甲状腺功能异常、肝功能指标异常等。更受临床医生所关注的3级及以上irAE均低于1.8%。作为一种免疫检查点抑制剂(ICI),阿得贝利单抗提高了ES-SCLC患者的2年生存率,为患者带来了长生存希望,更低的irAE也是保障患者真正获益的基本条件。期待阿得贝利单抗能早日上市,作为国产原研药物能够惠及更多SCLC患者。”
对于如何平衡免疫疗效与安全性的问题,王宝成教授作了详细阐述:“其一,筛选免疫治疗的优势人群。在既往免疫单药治疗研究中,我们看到有效率偏低,获益的患者有限,需要根据不同的生物标志物及相关指标寻找免疫治疗获益人群,发挥免疫治疗的最大疗效。其二,规范化治疗,免疫治疗前需要完善相关基线检查如影像学及相关实验室指标,规避免疫治疗所带来的严重毒性反应,密切观察免疫治疗的疗效。其三,对于irAE需及时进行诊断与鉴别,并按照分级治疗的原则,针对不同程度采取不同的处理方式,是否选择观察、停药还是住院甚至进入ICU需要多学科专家评估与诊治。对于irAE处理后恢复的这部分患者,重启免疫治疗需要进行慎重决策。其四,在免疫单药治疗的效率有限情况下,可以联合化疗、放疗及靶向药物实现协同增效,甚至在药物联合上选择新型ICI的双免疗法。或是联合免疫增强剂,如肿瘤疫苗及溶瘤病毒等。其五,免疫治疗的慎用、禁忌及特殊人群需要适当规避,例如免疫缺陷病毒性肝炎、高龄、接受器官或干细胞移植及胸腺瘤等患者。一旦发生免疫相关严重不良反应,需要在综合型三甲医院或肿瘤专科医院就诊处理,在多学科团队(MDT)讨论下进行规范化诊疗与指导。需要强调的是,为了保证用药安全性,免疫治疗需要在指南及适应症指导下进行规范化诊疗,而不是进行简单的药物替换或适应症前移。”
国产原研,贴近中国患者用药心声
治疗费用这一问题广受大家关注,王宝成教授结合目前国内患者经济现状指出:“目前已经获批的两款用于治疗SCLC的进口PD-L1抑制剂还未纳入医保报销范围,年治疗费用约在13万至16万,对于国内大多工薪阶层的患者家庭来说,经济负担沉重。由于经济费用的问题,我国SCLC患者整体采用免疫治疗的占比率相对较低,大部分患者仍采用传统化疗方案,因此中国SCLC患者平均生存期仍评论生存期仍难获改善。同时这也是国内临床实际诊疗中让医生与患者都束手无策的问题。阿得贝利单抗作为我国原研的PD-L1抑制剂,兼具更强的疗效和更优的安全性,为国内迫切需要免疫治疗的SCLC患者带来了双优+的治疗选择。期待恒瑞医药能够贴近中国国情,让更多SCLC患者用上好药,减轻患者经济负担,增加药物的可及性。”
“值得一提的是,除了ES-SCLC领域研究以外,阿得贝利单抗在局限期SCLC及围术期的非小细胞肺癌(NSCLC)领域有所布局,诸多Ⅲ期的注册研究正在进行之中。目前我国的制药企业当中,恒瑞医药是目前唯一拥有PD-1和PD-L1两个ICI的自主知识产权的制药企业。期待后续恒瑞医药能够开展更多药物上市后的真实世界临床研究,以获取多维度的数据支撑,造福更多肿瘤患者。”
总结
阿得贝利单抗作为我国首个原研一线治疗ES-SCLC的PD-L1抑制剂,其优异疗效和安全性为其带来了不错的治疗前景,期待阿得贝利单抗能够让更多的SCLC患者获得长期生存的机会。同时,在局限期SCLC、NSCLC甚至是其他瘤种治疗中能够有更多突破,使更多患者能够从免疫治疗种获益。
专家简介

王宝成 教授
解放军第960医院主任医师、教授、博士研究生导师
原济南军区总医院副院长、肿瘤学研究所所长
博士 、留美博士后
军队技术3级专家
国务院政府特殊津贴获得者
第三届“国之名医-卓越建树”称号获得者
CSCO常务理事
CSCO免疫治疗专委会主任委员
全军肿瘤专业委员会副主委
中央军委保健会诊专家
山东医师协会副会长
国家药物临床验证机构主任
《中华消化病与影像杂志》主编等
参考文献:
[1].Wang J, Zhou C, Yao W, et al. CAPSTONE-1 Study Group. Adebrelimab or placebo plus carboplatin and etoposide as first-line treatment for extensive-stage small-cell lung cancer (CAPSTONE-1): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022 Jun;23(6):739-747.
[2].Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |