*仅供医学专业人士阅读参考
新型ADC药物广泛覆盖HER2阳性/低表达晚期乳腺癌,未来可期。
一年一度的SABCS大会于当地时间2022年12月10日完美落幕,本次大会一如既往公布了一系列前沿进展,各项成果璀璨夺目,为乳腺癌患者带来全新的治疗选择和希望。其中新型ADC药物T-DXd再度携多项重磅研究精彩亮相,在HER2阳性、HER2低表达晚期乳腺癌治疗领域的研究成果备受领域学者关注。值此契机,医学界肿瘤频道特邀宋国红教授深入解读相关研究进展及临床意义。T-DXd的重磅研究DESTINY-Breast02(DB02)于2022年SABCS大会中正式公布研究结果,另一项里程碑式研究DESTINY-Breast03(DB03)也在本次大会中公布第二次中期分析结果,请您介绍这两项研究的数据亮点。
宋国红教授:早在2019年12月,基于单臂Ⅱ期DESTINY-Breast01研究的突破性获益,FDA附条件加速批准T-DXd用于至少接受过两种抗HER2的不可切除或转移性HER2阳性乳腺癌患者的治疗[1]。DB02研究是DB01的验证性Ⅲ期临床试验。该研究纳入既往接受过T-DM1治疗的HER2阳性晚期乳腺癌患者,评估T-DXd(5.4mg/kg)与医生选择方案(TPC,曲妥珠单抗/卡培他滨或拉帕替尼/卡培他滨)的有效性和安全性。共纳入608例患者,2:1随机至T-DXd组(406例)和TPC组(201例)。截至2022年6月30日,两组的中位随访时间分别为21.5个月和18.6个月,T-DXd组中23.3%的患者仍在接受治疗,而TPC组仅有2.6%的患者继续接受治疗[2]。
主要研究终点方面,相比TPC组,T-DXd组降低疾病进展或死亡风险64%,盲态独立审评中心(BICR)评估的中位PFS分别为17.8个月和6.9个月。研究者评估的PFS具有相同趋势,分别为16.7个月 vs 5.5个月。且PFS获益趋势不受年龄、激素受体状态、既往帕妥珠单抗治疗、内脏转移、既往治疗线数和脑转移状态等的影响。DB02研究进一步验证了DB01的数据结果,夯实了T-Dxd在后线治疗的地位。

图1. DB02研究中BICR评估的PFS获益及各亚组PFS获益
DB03研究则将T-Dxd的治疗地位进一步前移到晚期二线,头对头比较T-DXd与T-DM1的疗效和安全性的III期临床研究,也是T-DXd用于HER2阳性晚期乳腺癌二线治疗的第一项Ⅲ期试验。该研究共纳入524例患者按1:1随机分配分别接受T-DXd 5.4mg/kg或T-DM1 3.6mg/kg Q3W。截至2022年7月25日,共观察到169例OS事件。T-DXd组的中位随访时间为28.4个月,29.2%的患者仍在接受治疗;T-DM1组的中位随访时间为26.5个月,6.9%的患者继续接受治疗[3]。
本次大会更新的数据显示,主要研究终点BICR评估的中位PFS在T-DXd组为28.8个月,是T-DM1组6.8个月的4倍余,进展或死亡风险显著降低67%(95%CI 0.26-0.43;P<0.000001)。实际上,早在2021年ESMO大会中DB03研究的次要研究终点——研究者评估的PFS就已经达到25.1个月,这一数据的公布在当时引起了极大的轰动,已经超越了CLEOPATRA研究中曲帕双靶一线治疗的PFS结果(18.7个月)[4]。随着随访时间延长,T-DXd再次刷新了HER2阳性乳腺癌二线治疗的PFS获益纪录。不禁让人期待T-DXd在一线应用为HER2阳性晚期乳腺癌带来更富希望的治疗方案。
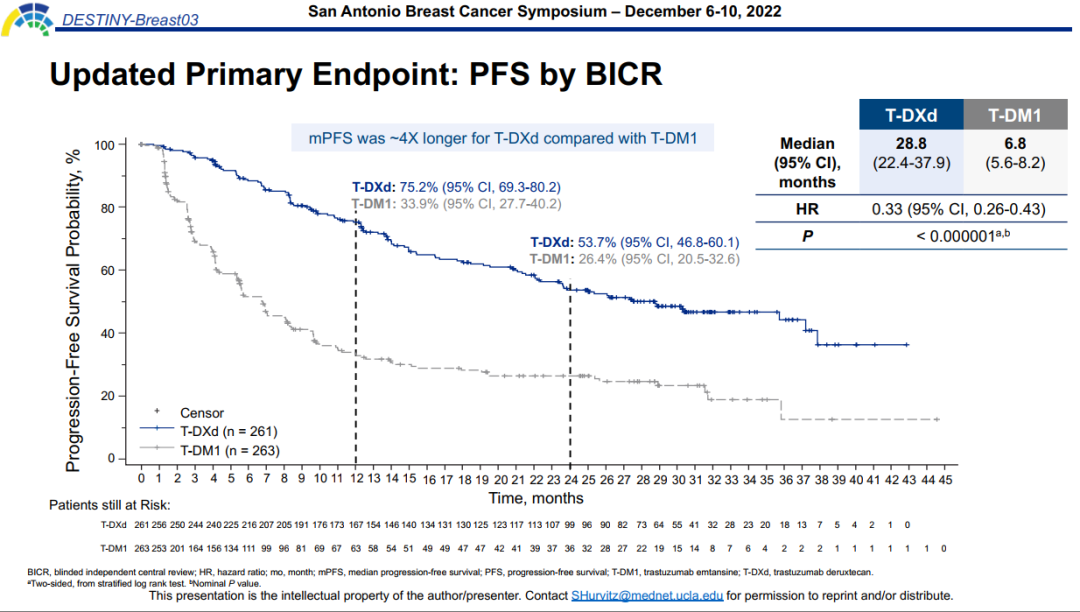
图2. DB03研究中BICR评估的PFS结果
另外,本次SABCS大会更新的数据显示,相比T-DM1,T-DXd可显著延长OS,降低死亡风险36%(HR=0.64,95%Cl 0.47-0.87,P=0.0037,超过预先规定的显著性界限P=0.013)。24个月OS率分别为77.4%和69.9%。并且,从公布的总生存KM曲线来看,后续两组的差异可能会随着随访时间延长而越来越明显。
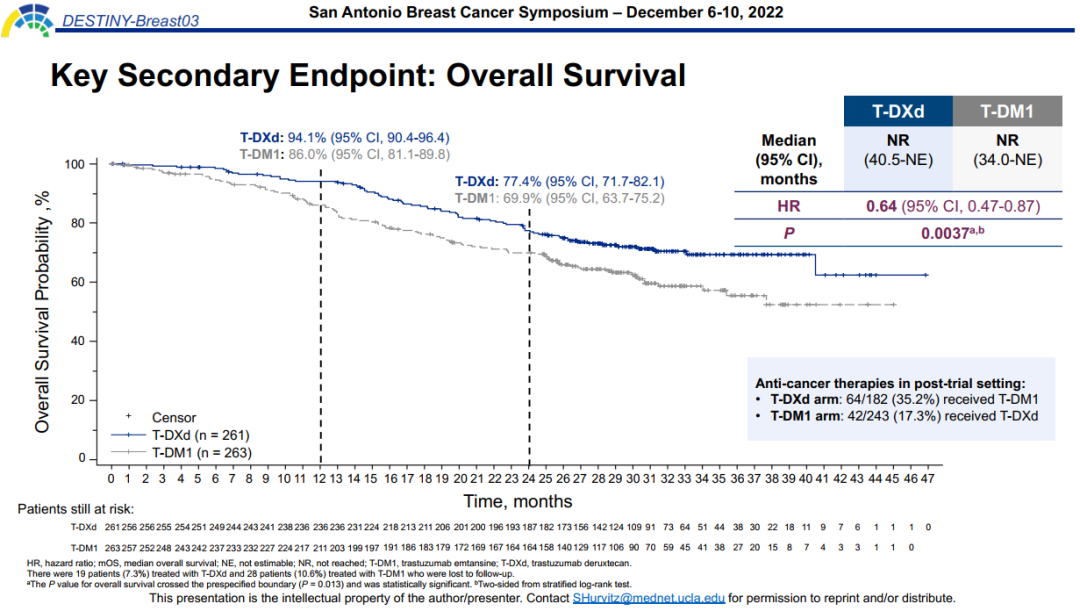
图3. DB03研究中OS结果
值得一提的是,DB03研究此次也公布了研究者评估的中位PFS2,两组分别为40.5个月和25.7个月。两组分别有70.8%和78.6%的患者接受了后续抗肿瘤治疗,其中T-DM1组有17.3%的患者使用了T-DXd。即便T-DM1组二线治疗进展后允许交叉接受T-DXd治疗,T-DXd组仍然具有更长的PFS2。这一显著获益提示,T-DXd在前线治疗更易获得较长PFS获益,也提示了“好药用在前线”的理念。
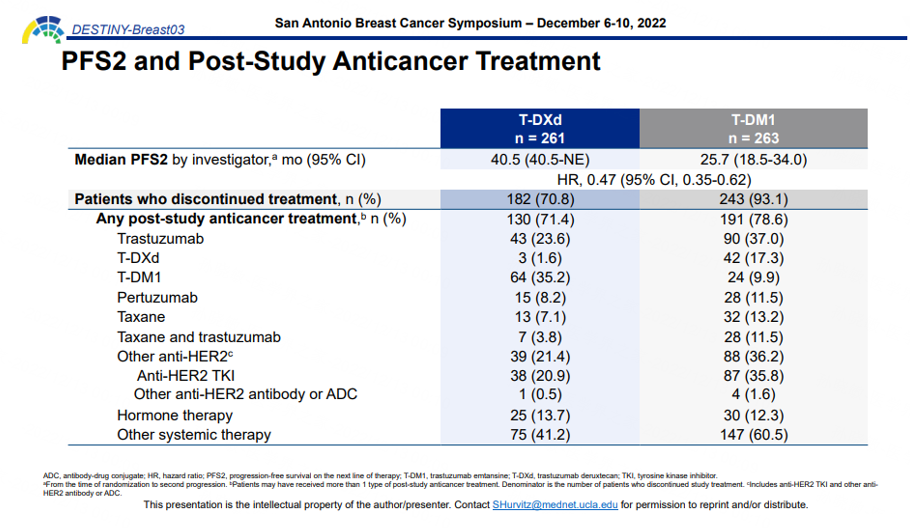
图4. DB03研究中接受T-DXd或T-DM1治疗发生疾病进展后的后续治疗以及PFS2
DESTINY-Breast04(DB04)是T-DXd在乳腺癌抗HER2治疗历史上又一个具有里程碑意义的关键研究,该研究在今年SABCS更新了亚组分析的结果,请您解读相关的研究数据。
宋国红教授:DB04是一项全球、随机、开放性、注册III期试验,评估了T-DXd(5.4mg/kg)对比TPC(卡培他滨、艾立布林、吉西他滨、紫杉醇或白蛋白结合型紫杉醇)治疗既往接受过1-2线化疗的HER2低表达不可切除和/或转移性乳腺癌患者。该研究在2022年ASCO大会上一经公布即引起业界轰动,在乳腺癌抗HER2治疗历史上具有里程碑意义,标志着T-DXd为HER2低表达这一类晚期乳腺癌患者人群带来新的靶向治疗标准,重塑了乳腺癌治疗格局。
该研究共纳入557例患者,以2:1的比例随机接受T-DXd或TPC治疗。主要研究终点为HR阳性患者中BICR评估的PFS,关键次要终点为总体人群中BICR评估的PFS,以及总体人群和HR阳性人群的OS[5]。
相较于TPC,T-DXd可使HR阳性/HER2低表达晚期乳腺癌患者的疾病进展或死亡风险显著降低49%,中位PFS几乎延长了一倍(10.1个月 vs 5.4个月)。中位OS分别为23.9个月 vs 17.5个月,死亡风险均降低36%。
总人群中T-DXd和TPC组中位PFS分别为9.9 vs 5.1个月,中位OS分别为23.4 个月 vs 16.8个月。
HR阴性患者中,两组中位PFS分别为8.5个月 vs 2.9个月。中位OS延长了一倍多,分别为18.2个月 vs 8.3个月。DB04研究中纳入了11.3%的HR阴性/HER2低表达人群,从疗效数据上看,T-DXd治疗既往接受过1-2线化疗的HR阴性/HER2低表达乳腺癌患者呈现出一定优势,可作为一线治疗进展后的重要选择方案。
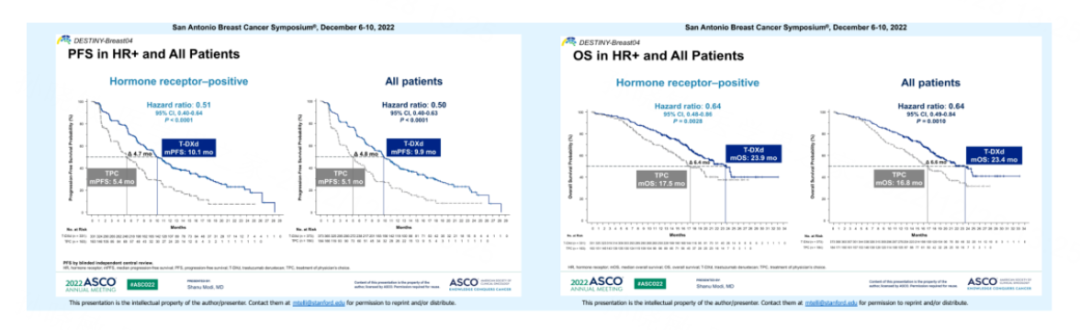
图5. DB04研究中HR阳性和总人群的PFS和OS
今年SABCS大会中公布了DB04研究的亚组分析数据,T-DXd治疗HER2低表达晚期乳腺癌的疗效在各亚组表现出一致性,与肿瘤负荷高低、既往是否使用过CDK4/6抑制剂、疾病是否快速进展、基线是否脑转移无关。其中,在接受过CDK4/6抑制剂进展后的HR阳性患者中,T-DXd和TPC组的中位PFS分别为10.0个月 vs 5.4个月,ORR分别为50.6%和13%,提示T-DXd或将为CDK4/6抑制剂经治的HR阳性/HER2低表达晚期乳腺癌提供后续治疗选择[6]。
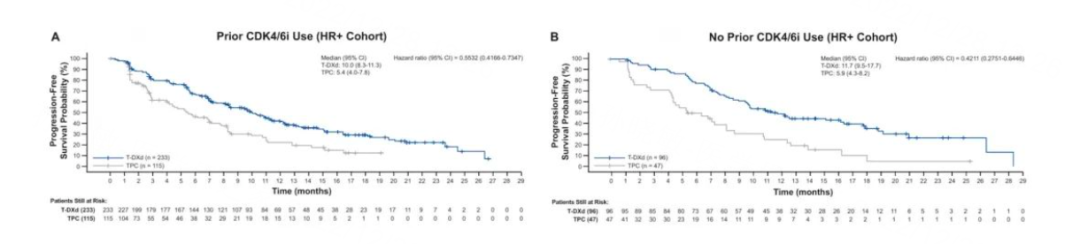
图6. DB04研究中是否CDK4/6抑制剂经治HR阳性患者的PFS
值得一提的是,在快速进展(在完成早期乳腺癌既往化疗后6个月内疾病进展)患者亚组中,T-DXd组有50%的患者达到客观缓解,而TPC治疗组为0%;同时,T-DXd组的中位PFS也长于TPC组。另外,既往使用/未使用过CDK4/6抑制剂、肿瘤负荷高或低,各亚组的总体安全性特征基本一致。总体而言,上述数据继续支持T-DXd作为新的标准治疗用于HER2低表达晚期乳腺癌患者[6]。
同时,本次大会中还更新了HER2低表达状态测定的数据,DB04研究的中心实验室使用PATHWAY HER2 4B5进行免疫组化检测,研究结果显示,既往病例报告为HER2低表达的患者于中心实验室检测的HER2低表达一致性为78%,提示HER2低表达的检测标准较为完备[7]。规范HER2检测流程,进行HER2判读培训和检测质控活动,乳腺癌的HER2检测结果也将更加精准,从而指导临床医生选择行之有效的治疗策略。
从后线到前线,ADC的探索无止境,本次SABCS大会还发布了两项T-DXd一线治疗晚期乳腺癌的研究成果,支持T-DXd单药或联合方案在晚期乳腺癌一线治疗的应用,进一步拓宽了T-DXd的获益人群。请您介绍T-DXd在晚期乳腺癌一线治疗中的研究数据。
宋国红教授:ADC药物引领了肿瘤靶向治疗的新时代,T-DXd作为ADC赛道的明星药物,具备高毒性、高均一性、强效旁杀者效应等优势,在HER2阳性晚期乳腺癌的后线治疗中大获成功。同时,T-DXd还将战线前移,在晚期乳腺癌一线治疗中布局了相关研究并取得了初步成果。
DESTINY-Breast07(DB07)是一项评估T-DXd联合其他多种药物用于HER2阳性晚期乳腺癌一线治疗的ⅠB/Ⅱ期研究。该研究的第一阶段为剂量探索阶段,包括T-DXd+度伐利尤单抗、帕妥珠单抗、紫杉醇、度伐利尤单抗+紫杉醇、图卡替尼等5个队列;第二阶段为剂量扩展阶段,包括T-DXd单药、前述5个队列以及T-DXd单药或联合图卡替尼用于活动性脑转移患者等8个队列(队列0-7)。主要终点是安全性和耐受性,并确定Ⅱ期临床研究的推荐剂量(RP2D)。次要终点为客观缓解率(ORR)和无进展生存期(PFS)(RECIST v1.1),PFS2,缓解持续时间(DOR),总生存期(OS)等。
本次SABCS大会公布了T-DXd单药和T-DXd+帕妥珠单抗一线治疗HER2阳性晚期乳腺癌的疗效分析结果[8]。截至2022年7月1日,单药组共纳入23例患者,联合组共22例患者,两组中位随访时间分别为11.0个月和10.0个月。在安全性方面,≥3级不良反应事件(AE)的发生率分别为30.4%和40.9%,严重AE发生率分别为8.7%和13.6%。在疾病缓解方面,单药组中87.0%的患者观察到肿瘤缩小,联合组中为81.8%。临床前研究表明,与单独给药相比,T-DXd联合帕妥珠单抗可更快速有效地内化,更大程度地降低HER2蛋白总量,并增强HER2表达细胞的内化。
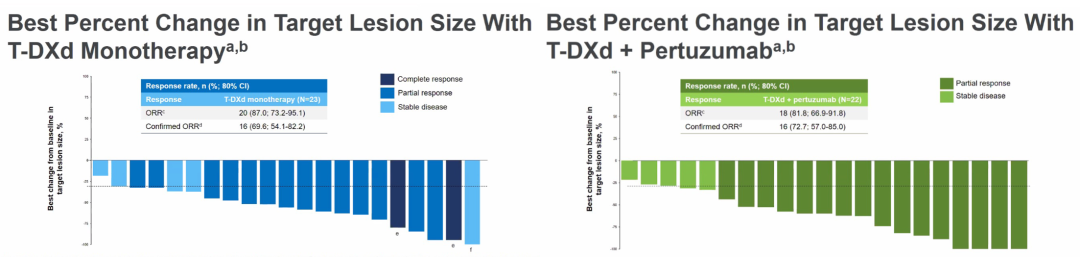
图7. DB07研究中T-DXd单药以及联合帕妥珠单抗治疗后靶病灶大小的最佳变化百分比
总体而言,T-DXd单药和联合帕妥珠单抗一线治疗HER2阳性晚期乳腺癌均展现出具良好的抗肿瘤活性,并且不良反应特征与T-DXd既往研究中报告的一致。这些结果支持T-DXd单药或联合帕妥珠单抗一线治疗在更大型临床研究中的应用。Ⅲ期临床研究DESTINY-Breast09将评估T-DXd联合或不联合帕妥珠单抗对比曲妥珠单抗+帕妥珠单抗+紫杉类化疗一线治疗HER2阳性晚期乳腺癌的疗效和安全性,是T-DXd挑战当前一线标准治疗方案的首个大型III期临床研究,期待此研究的成功重新定义HER2阳性晚期乳腺癌一线治疗的新标准。
此外,本次大会中还更新了BEGONIA研究中T-DXd联合度伐利尤单抗(队列6)的第二部分结果[9]。BEGONIA研究是一项多中心、多臂、开放标签的Ⅰb/Ⅱ期临床试验,旨在评价度伐利尤单抗联合其他疗法(包括ADC)用于晚期转移性三阴性乳腺癌(TNBC)一线治疗的疗效和安全性。其中,队列6纳入HR阴性/HER2低表达(IHC2+/ISH-、IHC1+/ISH-)患者,主要终点为安全性和耐受性。
截至2022年7月22日,共有58例患者接受了T-DXd+度伐利尤单抗治疗,其中28例患者仍在治疗中,10例患者因AE停用联合治疗,19例患者因疾病进展停用,4例患者因其他原因停用。中位随访时间为13.4个月。疗效评估显示,联合治疗的ORR为56.9%,IHC1+和IHC2+的患者分别为67.6%和38.1%。
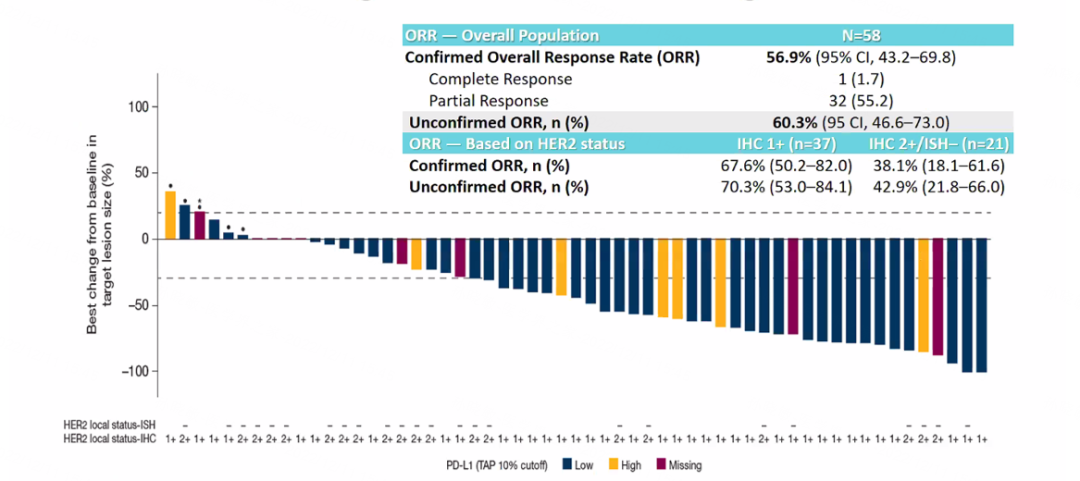
图8. BEGONIA研究中接受T-DXd+度伐利尤单抗治疗后靶病灶大小的最佳变化百分比及ORR
在安全性方面,未报告剂量限制性毒性。常见AE主要是消化道和血液学毒性;3/4级AE主要是血液学,最常见的是中性粒细胞减少(22.4%)和贫血(8.6%)。17.2%的患者因AE导致联合治疗停药,55.2%的患者因AE导致剂量中断。度伐利尤单抗相关≥10%的特殊影响AE(AESI)包括腹泻、甲状腺功能减退、ILD/非感染性肺炎和皮疹,大多数病例为1/2级。T-DXd治疗≥10%的AESI为ILD/非感染性肺炎,大多数病例为1/2级。对于HR阴性/HER2-low的晚期TNBC患者,T-DXd联合度伐利尤单抗一线治疗显示出可耐受且可管理的安全性特征,与单个药物的已知特征一致。
BEGONIA研究更新的结果再次证明了T-DXd联合度伐利尤单抗一线治疗HR阴性/HER2低表达晚期乳腺癌显示了良好的缓解率和安全性,且安全性良好,没有观察到剂量限制性毒性。支持此一线联合方案在HR阴性/HER2-low晚期乳腺癌中进行进一步探索。
总结
新型ADC药物T-DXd一经问世就引起业界广泛关注。最早基于DB01研究的惊艳疗效,T-DXd获批用于HER2阳性晚期乳腺癌的后线治疗。DB02研究完美验证了DB01的成果。随后,DB03研究中T-DXd成功挑战T-DM1,树立了HER2阳性晚期乳腺癌的二线治疗新标准。本次SABCS更新的数据显示,随着随访时间延长,T-DXd再次刷新二线治疗的PFS获益高度,并且PFS获益可以转化为OS获益,二线使用T-DXd也不会影响后续药物的疗效,夯实了T-DXd的二线治疗地位。不仅如此,T-DXd还布局HER2阳性晚期乳腺癌的一线治疗并取得了初步成果。希望DB09研究延续后线治疗的获益,成功挑战当前HER2阳性晚期乳腺癌一线治疗标准方案,再度改写乳腺癌治疗格局,为乳腺癌一线治疗带来新希望。
另外,DB04研究验证了T-DXd对HER2低表达晚期乳腺癌的确切疗效,填补HER2低表达乳腺癌治疗空白,开启了乳腺癌以治疗为导向的“HER2阳性、HER2低表达、HER2阴性”三分法分类的新时代。在单药取得突破性获益的同时,T-DXd也布局了联合治疗的研究探索,初步结果在BEGONIA及DB07研究中得以证实。期待T-DXd更多研究结果的公布进一步丰富晚期乳腺癌患者的治疗选择,惠及更多患者。
参考文献:
[1].Modi S, Saura C, Yamashita T, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. N Engl J Med. 2020 Feb 13;382(7):610-621.
[2].Krop I, Yeon H. Park YH, Kim SB, et al. Trastuzumab deruxtecan vs physician’s choice in patients with HER2+ unresectable and/or metastatic breast cancer previously treated with trastuzumab emtansine: primary results of the randomized, phase 3 study DESTINY-Breast02. 2022 SABCS. GS2-01.
[3].Hurvitz SA, Chung WP, Im SA, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: Updated survival results of the randomized, phase 3 study DESTINY-Breast03. 2022 SABCS. GS2-02.
[4].Swain SM, Miles D, Kim SB, et al. CLEOPATRA study group. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study. Lancet Oncol. 2020 Apr;21(4):519-530.
[5].Modi S, Jacot W, Yamashita T, et al. DESTINY-Breast04 Trial Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20.
[6].Harbeck N, Modi S, Jacot W, et al. Trastuzumab deruxtecan vs treatment of physician’s choice in patients with HER2-low unresectable and/or metastatic breast cancer: Subgroup analyses from DESTINY Breast04. 2022 SABCS. P1-11-01.
[7].Prat A, Modi S, Tsurutani JJ, et al. Determination of HER2-low status in tumors of patients with unresectable and/or metastatic breast cancer in DESTINY-Breast04. 2022 SABCS. HER2-18.
[8].Hamilton E, Jhaveri K, Loi S, et al; Dose-Expansion Study of Trastuzumab Deruxtecan as Monotherapy or Combined With Pertuzumab in Patients With Metastatic Human Epidermal Growth Factor Receptor 2-Positive (HER2+) Breast Cancer in DESTINY-Breast07 (DB-07). 2022 SABCS. PD18-11.
[9].Schmid P, Wysocki P, Park YH, et al; Trastuzumab deruxtecan (T-DXd) + durvalumab (D) as first-line (1L) treatment for unresectable locally advanced/metastatic hormone receptor-negative (HR−), HER2-low breast cancer: updated results from BEGONIA, a phase 1b/2 study. 2022 SABCS. PD11-08.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |