
编译丨望夜
丙型肝炎病毒(Hepatitis C virus,HCV)是病毒性肝炎的主要诱因之一。由于患者感染病毒后往往长期不表现症状,HCV常被称为“沉默的杀手”。据估计,全球范围内的HCV长期感染者超过5800万,每年新增感染150万,仅2019年就有约58万人死于HCV引起的疾病,主要是肝硬化或肝癌【1】。得益于口服抗病毒药物的成功上市,HCV感染的治愈率已可超过95%。为此,丙肝研究领域的专家曾先后问鼎美国拉斯克奖和诺贝尔生理和医学奖。遗憾的是,目前仍然没有可以有效预防HCV感染的疫苗。
HCV是具有囊膜的单股正链RNA病毒,隶属黄病毒科(Flaviviridae)丙型肝炎病毒属(Hepacivirus)。其基因组共编码10种蛋白,N端的前三个(E、E2、P7)为结构蛋白。E1和E2相互作用共同构成囊膜病毒表面唯一的糖蛋白复合物,其中E2负责结合受体CD81、SR-B1等,E1上含有病毒融合肽。但长期以来,E1E2复合物结构始终未获解析,这主要由于两种蛋白结构多变,如E2上超过50%的区域呈不规则折叠构象;且E1E2上二十多个半胱氨酸之间极易错误交联形成不规则聚体。此外,大量的糖基化修饰加剧了蛋白的不均一性。E1E2复合物结构的缺失也阻碍疫苗的开发进程。
尽管困难重重,研究者仍通过不懈努力获得了E2、E1的部分结构。2013年底、2014年初,Science和Nature杂志先后报道HCV E2核心区与抗体的结构,发现其构象呈中心的β三明治结构及包裹着它的前页和后页形式【2-3】。该结构模式不同于已知的病毒囊膜蛋白I\II\III型组织形式,因此有研究者提出E2应为IV型病毒囊膜蛋白【4】。同时,E1的结构解析也取得进展,其N端79个氨基酸的晶体结构率先获得解析,呈两对二硫键相连的同源二聚体,每个单体包含5个β-折叠片及一个α-螺旋组成【5】,但推测的融合肽区域结构未获得解析。基于解析的E2、E1晶体结构,研究者通过软件预测出E1E2异源二聚体的全长结构【6】。伴随着结构解析,报道了一系列中和抗体,它们的表位也得到鉴定。去年,HCV E2与受体CD81的复合物结构也获得解析【7】。以上结构信息的获取,为E1E2结构最终突破奠定基础。
近日,Science杂志以研究长文形式报道美国Scripps研究所的Andrew B. Ward课题组与荷兰阿姆斯特丹大学的Rogier W. Sanders合作的成果论文Structure of the hepatitis C virus E1E2 glycoprotein complex,通过共表达E1E2与抗体纯化出高度均质的复合体蛋白,并借助冷冻电镜解析得到E1E2结构。

本文作者选取的是1a亚型的AMS0232毒株。他们巧妙地将带有StrepII-tag的E2抗体AR4A的Fab与E1E2异源二聚体共表达,利用StrepTactin可将抗体与E1E2一起纯化出来。负染电镜显示结合AR4A的E1E2均质性优于不结合抗体的状态,且AR4A的结合不影响E1E2与其它单克隆抗体及受体CD81的结合。为进行冷冻电镜研究,作者还将上述复合物与另一株E2抗体AT1209 Fab共表达,将复合物重建到peptidiscs上,再添加第三种E1抗体IGH505的Fab。但即便结合三种Fab,E1E2全长复合体的分子量仍相对较小且结构不稳定,难以进行高分辨率电镜重构。为此,作者使用cryoSPARC【8】的3D变异性分析处理离散和柔性两种构象下二聚体与三抗体的结构,最终将胞外结构域分辨率处理到3.5Å,柔性区处理到3.8Å。
最终解析出的结构模型(图1)中,E1E2界面、三种抗体的表位及糖被(glycan shield)清晰可见,占E1的51%,E2的82%。E2的高度可变区1(HVR1)、412-429位(表位412)、及E1\E2跨膜区、E1上的融合肽区域目前无法建模。
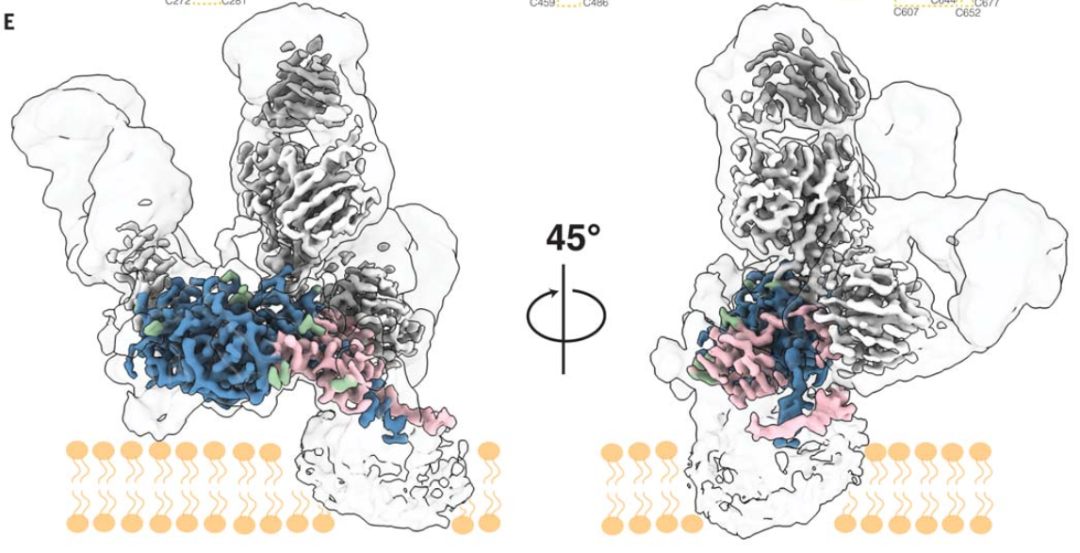
图1 结合有三种抗体的E1E2结构模型(其中抗体用灰色显示,红色为E1,蓝色为E2,绿色表示糖基化修饰)
本次获得的E1E2结构可以提供哪些信息呢?
首先是亚结构域组织形式。E2的三个亚结构域(头部区、茎部区、跨膜区)中,头部区与此前通过晶体结构解析的重组E2结构(PDB:6MEI)十分吻合。本次新获得两个区域的结构——头部区基部一段包含反平行β折叠的loop、及茎部区结构。E1结构模型包含核心区和茎部区,其中核心区N端结构域(NTD)与此前报道的晶体结构差别较大,表明E1的正确折叠需要E2辅助。E1茎部区与已解析结构吻合较好。
其次是二硫键网络。本次获得的结构模型中,E2上形成9组二硫键,与此前报道的一个E2胞外域与抗体结构【8】基本一致,仅C652-C677未在此前结构中出现。E1上有3组二硫键可以直接观察到,Alphafold预测显示还存在第4组二硫键。
再次是E1E2界面信息。作者提出“茎部握持”模型用于描述E1胞外段包裹着E2茎部区的结构模式。与此前报道一致,E1E2之间通过非共价键相互作用,主要是形成疏水相互作用和氢键。其中,E2茎部区上有一段连续疏水区域用于稳定E1E2二聚体界面,基部区带有一个疏水凹槽与E1上对应的疏水氨基酸形成一系列互作。此外,E1上的两个N-糖基侧链与E2上的氨基酸形成盐桥和π-π相互作用,进一步支撑E1E2界面的稳定性。突变体假病毒入侵实验证实界面上的关键氨基酸对病毒感染性至关重要。
然后是糖修饰。作者发现E1E2上所有的N-糖修饰都位于结构的一侧,另一侧高度保守且呈疏水性应为靠近病毒囊膜的部分。除去鉴定到全部NXT和NXS型的N糖修饰,作者还在E2的N695位发现罕见的NXV型N-糖修饰,但该糖修饰基本不影响蛋白的抗原性,对病毒感染性略有影响。此外发现糖修饰类型多为寡聚甘露糖。
最后是确认三种抗体的表位。与此前研究结果不同,复合物结构显示AR4A仅结合E2的后页和基部区,且发现AR4A在E2上的表位是动态稳定的,需要E1稳定构象,推测AR4A可能的中和机制是将E1E2稳定在融合前构象从而阻止感染过程中的变构。IGH505靶向E1表面暴露的保守α螺旋,可能的中和机制是阻止E1E2构象变化。AT1209靶向E2上的AR3表位,即前页和受体结合loop,因此可以通过竞争受体结合位点提供中和活性。
总之,本文作者通过巧妙的共表达策略成功获得HCV E1E2复合物结构,获得一系列分子细节,为新一代疫苗和治疗性药物的设计提供关键信息。当然仍有不少未知信息留待后续研究揭晓,如此前研究曾报道E1E2间可形成二硫键【10】,但本次解析的结构显示两者通过非共价键结合,是否存在其他构象状态的复合物及其与病毒颗粒感染性的关系目前尚不清楚。
原文链接:
http://science.org/doi/10.1126/science.abn9884
参考文献
1. https://www.who.int/news-room/fact-sheets/detail/hepatitis-c
2. L. Kong et al., Science342, 1090–1094 (2013).
3. A. G. Khan et al, Nature 15;509(7500):381-384 (2014).
4. Y. Li & Y. Modis, Trends Microbiol; 22(4):176-182 (2014).
5. K.E. Omari et al, Nat Commun. Sep 16; 5: 4874 (2014).
6. H. Freedman et al., Journal of Virolog; 91: e02309-02316 (2017).
7. A. Kumar et al., Nature598, 521–525 (2021).
8. A. Punjani, D. J. Fleet, J. Struct. Biol.213, 107702 (2021).
9. A. I. Flyak et al., Cell Host Microbe24, 703–716.e3 (2018).
10. G. Vieyres et al., J. Virol.84, 10159–10168 (2010).


想了解更多精彩内容,快来关注BioArt生物艺术
| 留言与评论(共有 0 条评论) “” |